
科目: 来源: 题型:
【题目】有关苯的结构和性质,下列说法正确的是
A.![]() 的习惯命名是间二甲苯
的习惯命名是间二甲苯
B.苯在空气中不易燃烧完全,燃烧时冒浓烟
C.煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
D.向2mL苯中加入1mL酸性高锰酸钾溶液,振荡后静置,可观察到液体分层,上层呈紫红色
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液加热反应可制取氯气,他们设计如下实验用于制取氯气并验证其性质。
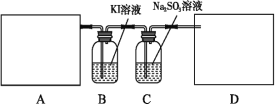
试回答:
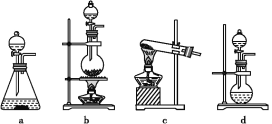
(1)该实验中A部分的装置是___________ (填写字母)。A部分的装置中发生反应的化学方程式为:___________。
(2)B中的发生反应的离子方程式为____________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因:___________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)__________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年11月4日是《巴黎协定》气候协议生效的日期,其宗旨是提高绿色低碳转型的竞争力、抵御气候变化,人们需要用不同的方法将CO2进行转化利用。
(1)处理CO2的方法之一是使其与氢气反应合成甲醇。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(1) △H=-283.0kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1) △H=-726.0kJ·mol-1
写出二氧化碳与氢气合成甲醇液体的热化学方程式_________;
(2)CO2经催化加氢还可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H=QkJ·mol-1在0.1MPa时,按n(CO2):n(H2)=1:3投料,右图表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
C2H4(g)+4H2O(g) △H=QkJ·mol-1在0.1MPa时,按n(CO2):n(H2)=1:3投料,右图表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
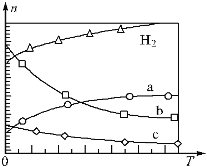
①Q______0(填“>”、“=”或“<”);
②曲线b表示的物质为_____。
(3)在强酸性的电解质水溶液中,用惰性材料做电极,电解CO2可得到多种燃料,其原理如右图所示。

①该工艺中能量转化方式主要有______;
②电解时,生成丙烯(C3H6)的电极反应式为______。
(4)以CO2为原料制取碳(C)的太阳能工艺如右图所示。

①过程1中发生反应的化学方程式为______;
②过程2中每生成1molFe3O4[FeOFe2O3]转移电子的物质的量为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如图所示装置制备氯气并进行一系列相关实验(夹持设备及必要的加热装置已省略)。
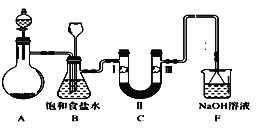
(1)整套装置装配完毕后,首先进行的操作是___,再添加试剂。
(2)实验室常用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O制取氯气:
MnCl2+Cl2↑+2H2O制取氯气:
①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为____。
②标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为___mol。
(3)洗气装置B的作用是除去Cl2中的HCl气体,同时用作安全瓶(监测实验时装置C中是否发生堵塞)。若装置C发生堵塞,装置B中将观察到的现象是___。
(4)装置C的作用是验证氯气是否具有漂白性。为此,实验时装置C中I、II、III处依次放入的物质是____(填字母)。
A | B | C | D | |
I | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(5)向品红溶液中同时通入氯气和二氧化硫(按物质的量之比1:1),观察到的现象是___。用化学方程式解释一下原因___。
(6)F为尾气吸收装置。实验时,该装置中反应的离子方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2.
8Cu+4FeO+2Fe2O3+16SO2.
(1)若CuFeS2中Fe的化合价为+2,反应中被还原的元素是__(填元素符号).
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在Fe3+的方法是__(注明试剂、现象).
(3)上述冶炼过程产生大量SO2.下列处理方案中合理的是__(填代号)
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是__.
(5)实验室制备,收集干燥的SO2,所需仪器如下.

①其中装置A产生SO2,反应的化学方程式为__.
②请按气流方向连接各仪器接口,顺序为a→__→ → → f,装置E中NaOH溶液的作用是__.E中反应的离子方程式__.
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学欲探究NH3的催化氧化反应,按下图装置进行实验。A、B装置可选用的药品:浓氨水、H2O2溶液、蒸馏水、NaOH固体、MnO2。
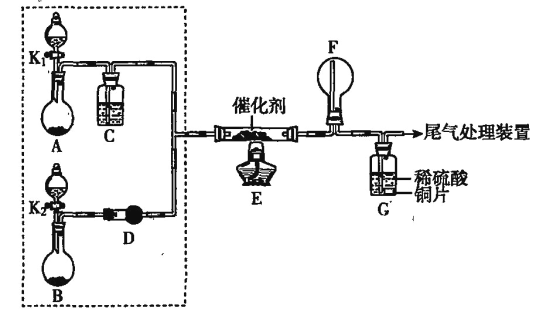
(1)NH3催化氧化的化学方程式是__________。
(2)甲、乙两同学分别按上图装置进行实验。一段时间后,装置G中的溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是__________。
②乙观察到装置F中只有白烟生成,白烟的成分是__________(填化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:__________。
(3)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进:
①甲认为可调节K1和K2控制A、B装置中的产气量,应__________(填“增加”或“减少”)装置A中的产气量,或__________(填“增加”或“减少”)装置B中的产气量。
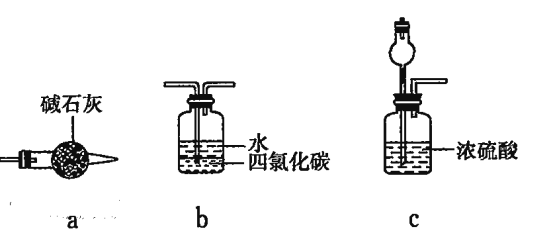
②乙认为可在装置E、F间增加置,该装置可以是__________(填字母序号)。
(4)为实现该反应,也可用下图所示的装置替换题.给装置中虚线框部分,
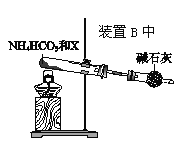
化合物X为__________。NH4HCO3的作用是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】目前世界锂离子电池总产量超过30亿只,锂电池消耗量巨大,黄石一重点中学化学研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如图:
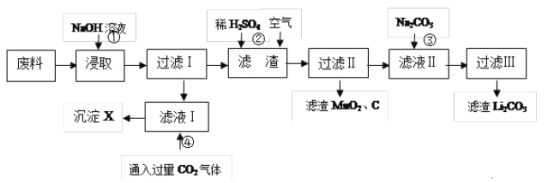
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)写岀氢氧化钠的电子式___。
(2)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是___。
(3)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求___。
(4)写出反应④生成沉淀X的离子方程式___。
(5)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:___。
(6)生成Li2CO3的化学反应方程式为___。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应___。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是

A. 洗气瓶中产生的沉淀是碳酸钡B. 洗气瓶中产生的沉淀是亚硫酸钡
C. 在Z导管出来的气体中没有二氧化碳D. 在Z导管口有红棕色气体出现
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
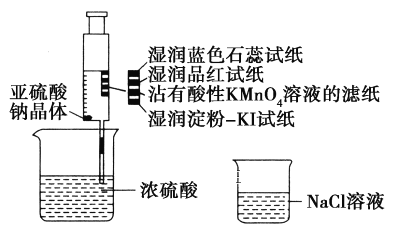
A. 蓝色石蕊试纸先变红后褪色
B. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
C. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
D. NaCl溶液可用于除去实验中多余的SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
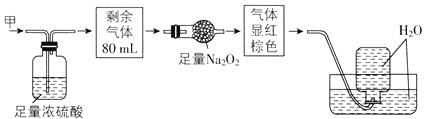
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com