
科目: 来源: 题型:
【题目】下列解释事实或实验现象的化学用语正确的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ ![]() 2I2+2H2O
2I2+2H2O
B. 铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3-![]() Fe3+ + NO↑+ 2H2O
Fe3+ + NO↑+ 2H2O
C. 水垢上滴入CH3COOH溶液有气泡产生:CaCO3+2H+ ![]() Ca2++CO2↑+ H2O
Ca2++CO2↑+ H2O
D. SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O ![]() CaSO3↓+2HClO
CaSO3↓+2HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物M由两种位于第四周期的过渡金属元素和一种位于第三周期的非金属元素组成,一定条件下M存在如图所示转化。已知:固体Y中两种金属元素的化合价分别为+2、+3。下列有关推断错误的是( )
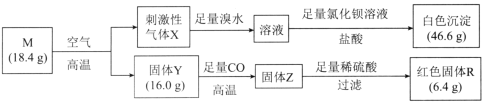
A.气体X能使品红溶液、酸性高锰酸钾溶液、含酚酞的碳酸钠溶液褪色
B.溴水吸收气体X的离子方程式为Br2+2H2O+SO22HBr+2H++SO![]()
C.根据上述数据推知,M的化学式为CuFeS2
D.向KNO3和稀盐酸的混合溶液中加入少量固体Z,固体Z全部溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.在光照条件下,等物质的量的![]() 与
与![]() 充分反应,只能生成
充分反应,只能生成![]() 和
和![]()
B.对石油分馏产品进行催化裂化,可以提高汽油等轻质油的产量和质量
C.乙炔能使酸性高锰酸钾溶液和溴水褪色,两者褪色的原理不同
D.邻二甲苯只有一种结构,说明苯中的碳碳键是完全相同的
查看答案和解析>>
科目: 来源: 题型:
【题目】氯元素是中学化学中常见的重要非金属元素之一,氯元素的单质及其化合物在生产与生活中有着重要的用途,依据所学知识完成下列问题:
Ⅰ.实验室制备氯气的化学方程式是_____________________;多余的氯气用氢氧化钠溶液吸收,其离子方程式为_________________
Ⅱ.常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生组织(WHO)列为高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,还有 NaCl与C12生成。
(1)写出并配平该反应的化学方程式____________________。
(2)如果反应中生成标准状况下11.2L 氯气,则被氧化的 HCl的物质的量为_______,转移电子数为_________。
(3)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2,通入到含有H2S(二元弱酸)的水中,再向共中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】污水处理厂处理含CN-废水的过程分两步进行:①向含CN-的废水中加入过量NaC1O将CN-转化为CNO-;②调节①所得溶液为酸性,使CNO-继续被NaC1O转化为两种无污染的气体。下列关于上述过程的叙述错误的是( )
A.CN-的电子式为![]()
B.过程①中,生成CNO-的反应中氧化剂与还原剂的物质的量之比为1:1
C.过程②中,生成的两种无污染的气体为CO2和N2
D.氧化性:CNO->C1O-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A是一种常见金属,F 是一种红褐色沉淀,试根据图中转化关系,回答下列问题。
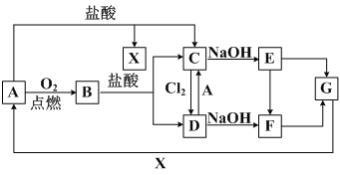
(1)写出A、C、F、G的化学式:A_________,C________,F________,G_________。
(2) 检验D中阳离子的方法为________________________
(3) 保存C溶液时要加固体A的原因__________________
(4) 写出下列转化的离子方程式或化学方程式。
①E→F 的化学反应方程式:_________________________
②C→D的离子反应方程式:_________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体中可能含有Na+、K+、Al3+、Ba2+、SO42-、CO32-、SiO32-、等离子,将其配成 100mL 溶液。学生研究性学习小组为了确认其成分,设计并完成了如图所示实验:

请回答下列问题:
(1)配制100mL 溶液需要使用容量瓶,该仪器使用前必须进行的一步操是______________;在“定容”操作中,当液面接近容量瓶刻度线1~2cm 处,改用__________________,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(2)若出现如下情况,导致所配溶液浓度偏高的是_____________________
A.称量时砝码已经生锈;
B.溶解、转移溶液之后没有对烧杯和玻璃棒进行洗涤操作;
C.定容时俯视;
D.定容时,液面超过容量瓶颈上的刻度线,用胶头滴管将过量的液体吸出;
E.容量瓶不干燥,含有少量蒸馏水。
(3) 根据以上实验可得出:一定存在的离子是_________________,,一定不存在的离子是___________________。
(4) 加入稀盐酸,所发生的离子反应方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列8种物质:①液氯;②铜;③熔融NaHSO4;④Fe(OH)3固体; ⑤ 盐酸;⑥蔗糖;⑦干冰;⑧红磷固体;⑨ AgCl; ⑩CH3COOH晶体,请按要求回答下列问题(填写物质编号)。
(1) 上述状态下能导电的是_________________________;
(2) 属于电解质是______________;
(3) 属于非电解质的是_______________;
(4) 3.1 g红磷在氯气中充分反应后,生成三氯化磷与五氯化磷的物质的量之比为1:3 , 该反应的化学方程式为___________________;
(5) 写出④与⑤反应的离子方程式________________________;
(6) 写出往NaHSO4溶液中沛加Ba(OH)2溶液至溶液呈中性时的离子方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】镁-空气电池是一种新型燃料电池,其工作原理如图所示。下列说法错误的是( )
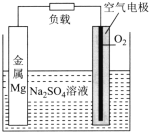
A.金属Mg电极为负极,其电势低于空气电极的电势
B.电子流向:Mg电极→导线→空气电极→电解质溶液→Mg电极
C.电池总反应为2Mg+O2+2H2O=2Mg(OH)2
D.回收后的氢氧化镁经一系列转化,可重新制成镁锭循环利用
查看答案和解析>>
科目: 来源: 题型:
【题目】向200mL FeBr2溶液中逐渐通入C12,其中n(Fe3+)、n(Br2)随通入n(Cl2)的变化如图所示,下列说法不正确的是( )
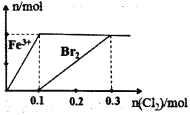
A.氧化性强弱:Br2>Fe3+
B.由图可知,该FeBr2溶液的浓度为1molL─1
C.n(Cl2)= 0.12 mol时,溶液中的离子浓度有c(Fe3+):c(Br-)=1:8
D.c(FeBr2):c(Br2)= 1: 1时,反应的离子方程式:2Fe3++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com