
科目: 来源: 题型:
【题目】下列对相关实验的叙述符合事实的是
A.铁与水蒸气在高温下的反应产物为Fe3O4和H2
B.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中缓慢地加入一绿豆粒大的金属钠,可能观察到的现象是如图

C.用洁净的铂丝蘸取待测液,置于酒精灯火焰上灼烧,观察到火焰呈黄色,则表明待测液中一定含有Na+而不含K+
D.用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来
查看答案和解析>>
科目: 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
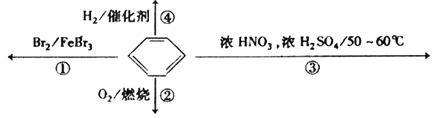
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目: 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学反应方向及其判据的说法中错误的是( )
A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B.自发进行的反应一定能迅速进行
C.CaCO3(s)![]() CaO(s)+CO2(g)△H>0能否自发进行与温度有关
CaO(s)+CO2(g)△H>0能否自发进行与温度有关
D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
查看答案和解析>>
科目: 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
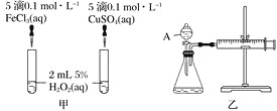
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
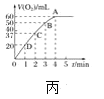
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、Mg2+、SCN﹣、Cl﹣
B.c(H+)=10﹣12 molL﹣1的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
C.c(Fe2+)=1 molL﹣1的溶液中:K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]()
D.能使甲基橙变红的溶液中:Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101 kPa时,1 g N2H4在氧气中完全燃烧生成氮气和H2O,放出19.5 kJ热量(25℃时),表示N2H4燃烧的热化学方程式是:______________________________。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4 mol液态肼和足量液态H2O2反应,生成氮气和液态水,放出327.05 kJ的热量。写出该反应的热化学方程式:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g)![]() xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(Lmin),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(Lmin),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com