
科目: 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下图所示的三套实验装置:

(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是________(填装置序号)。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了Ba(OH)2溶液与稀硫酸,U形管中可观察到的现象是_________________________________。说明该反应属于________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在丙试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_________________。
②若观察到烧杯中产生气泡,则说明M溶于水________(填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是_________________________________________。
(4)至少有两种实验方法能验证超氧化钾与水的反应(4KO2+2H2O===4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择装置________(填装置序号)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到脱脂棉燃烧,则说明该反应是________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】看图回答下列问题
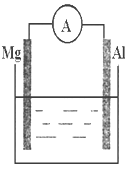
(1)若烧杯中溶液为稀硫酸,则观察到的现象是__________,电流表指针_______(填偏转或不偏转),两极反应式为:
正极_______________________;
负极________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为__________(填Mg或Al),总反应方程式为__________。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右下图所示:A、B两个电极均由多孔的碳块组成。
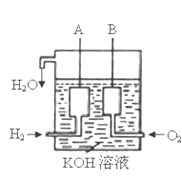
该电池的正极反应式为:_____________________。
(4)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电 池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:苯和卤代烃在催化剂的作用下可以生成烷基苯和卤化氢,C是生活中常见的有机物,75%的C溶液可用于医用消毒,乙苯能被酸性高锰酸钾溶液氧化为苯甲酸.几种物质之间的转化关系如图所示(生成物中所有无机物均已略去).
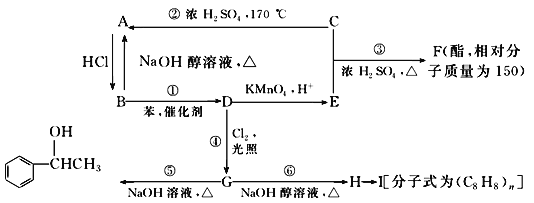
请回答下列问题:
(1)写出物质的结构简式:D________;I________.
(2)在①~⑥6个反应中,属于消去反应的是________(填编号)
(3)写出下列反应的化学方程式:
①______________________________________;
⑤______________________________________;
(4)写出一种符合下列要求的F的同分异构体的结构简式:F的同分异构体中属于酯类,能发生银镜反应,且苯环上的一氯取代物只有两种:______________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在做原电池原理的实验时,有如下实验步骤:
①用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接(如图1);
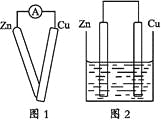
②把一块纯净的锌片插入盛有稀硫酸的烧杯中;
③把一块纯净的铜片插入盛有稀硫酸的烧杯中;
④用导线把锌片和铜片连接起来后,再平行地插入盛有稀硫酸的烧杯中(如图2)。
回答下列问题:
(1)实验步骤①中应观察到的现象是_______________________。
(2)实验步骤②中应观察到的现象是_______________________。
(3)实验步骤③中应观察到的现象是_______________________。
(4)实验步骤④中应观察到的现象是_______________________。
(5)通过实验步骤④该同学头脑中有了一个猜想(或假设),该猜想是_______。
(6)为了证实该猜想,该同学又设计了第⑤步实验,请简要画出第⑤步实验的装置示意图。______
查看答案和解析>>
科目: 来源: 题型:
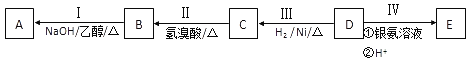
【题目】有机物D,质谱图表明其相对分子质量为86,将8.6gD完全燃烧的产物依次通过装有浓硫酸和碱石灰的装置,浓硫酸中增重9g,碱石灰中增重22g.其相关反应如图所示,其中B、D、E的结构中均含有2个﹣CH3,它们的核磁共振氢谱中均出现4个峰。
请回答:
(1)B中所含官能团的名称为________;D的分子式为________;
(2)Ⅲ的反应类型为________(填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(3)写出下列反应的化学方程式:
Ⅰ:___________________________________;
Ⅳ:__________________________________;
(4)C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为________________________;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个﹣CH3 , 它们的结构简式为________和________;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为________.
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
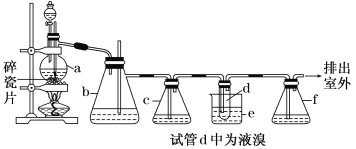
有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在装置c中应加入________(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是______________________。
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是______________________; 但不用冰水进行过度冷却,原因_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】保险粉(Na2S2O4)可用作食品保鲜剂、纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。锌粉法制备Na2S2O4的工艺流程如图所示:

回答下列问题:
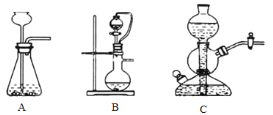
(1)实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
(2)工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_________;步骤Ⅰ中发生反应的化学方程式为__________。
(3)步骤Ⅱ中需选用的玻璃仪器除了烧杯、玻璃棒之外,还有__________(填名称)。
(4)在步骤III中加入NaCl的作用是_______,得到的Na2S2O4固体要用乙醇洗涤,其优点是_________。
(5)铁氰化钾可用于分析检测保险粉。铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将![]() 氧化为
氧化为![]() ,[Fe(CN)6]3还原为[Fe(CN)6]4,该反应的离子方程式为___________;取1.16g Na2S2O4样品溶于水,用0.4mol·L1的K3[Fe(CN)6]标准液滴定至终点,消耗25.00mL。该样品中Na2S2O4的质量分数为________。
,[Fe(CN)6]3还原为[Fe(CN)6]4,该反应的离子方程式为___________;取1.16g Na2S2O4样品溶于水,用0.4mol·L1的K3[Fe(CN)6]标准液滴定至终点,消耗25.00mL。该样品中Na2S2O4的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为 ___________。滤渣2的主要成分是(写化学式)_________。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________。
(3)一般地说 K>105 时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、______、______、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为__________。
(6)Li2CO3是制备金属锂的重要原料, 一种制备金属锂的新方法获得国家发明专利,其装置如图所示:

工作时电极 C 应连接电源的______极,阳极的电极反应式为__________ 。该方法设计的 A 区能避免熔融碳酸锂对设备的腐蚀和因________逸出对环境的污染。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
(1)A的名称是________.
(2)③的反应类型是________,④的反应类型是________.
(3)反应②的化学方程式是________
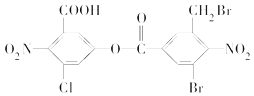
(4)某有机物的结构简式如图所示.1mol该有机物与足量的NaOH溶液共热,充分反应后质的量为________ mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com