
科目: 来源: 题型:
【题目】最近,中国科学家在《焦耳》杂志在线发表的一篇论文中首提“液态阳光”,即“太阳燃烧”,属于可再生绿色液态燃料。某模拟“人工树叶”的“液态阳光”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料异丙醇(CH3)2CHOH。下列说法正确的是

A.该装置将化学能转化为光能和电能
B.a电极反应为3CO2+ 16H+- 18e-= (CH3)2CHOH + 4H2O
C.该装置工作时,H+从b极区向a极区迁移
D.异丙醇可发生氧化反应、还原反应、取代反应和聚合反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。有关化工原料苯乙炔![]() 的下列叙述正确的是
的下列叙述正确的是
A.51 g该物质中含有单键数目为2NAB.标准状况下,22.4 L苯乙炔最多消耗2NA个HCl
C.1mol苯乙炔分子中共线的原子数最多为6NAD.苯乙炔与足量H2加成产物的一氯代物有5种
查看答案和解析>>
科目: 来源: 题型:
【题目】由黏土(主要成分Al2O3·2SiO2·2H2O,含少量Fe2O3、CaO、MgO等杂质)与磷肥生产的含氟废气生产冰晶石Na3AlF6的工艺流程如下:
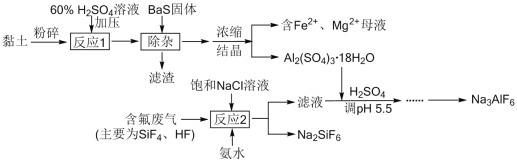
请回答下列问题:
(1) 冰晶石在电解Al2O3制铝中的作用是______,需定期更换石墨______(填“阳”或“阴”)极。
(2) 不用98%硫酸进行“反应1”的可能原因是______。
A.不易发生离子反应,造成浸出率下降
B.反应速率太快太剧烈,造成了操作危险
C.产生较多酸性废液,也提高了原料成本
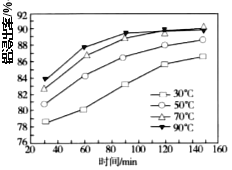
(3) 保持其他条件不变,反应1的铝浸出率在不同温度下随时间变化如图所示。“反应1”的最佳温度与时间分别是______℃、______min。
(4) “除杂”步骤产生的“滤渣”中含有BaSO4、CaSO4、S等难溶物,写出产生S的离子方程式______。
(5) 若按“黏土![]() 滤液
滤液![]() 溶液
溶液![]() ”来制备Al2(SO4)3·18H2O,该方案的原料利用率比原方案更______ (填“高”或“低”)。
”来制备Al2(SO4)3·18H2O,该方案的原料利用率比原方案更______ (填“高”或“低”)。
(6) “反应2”所得“滤液”中含氟物质主要为______ (写化学式)。
(7) 已知Ka(HF)= 6.4×10-4,Al3++ 6F-![]() AlF
AlF![]() 的K=1.0×1019,欲使平衡时c(AlF
的K=1.0×1019,欲使平衡时c(AlF![]() )/c(Al3+)≥10,且调节并维持滤液pH=5.5,则其中HF平衡浓度应不低于______mol/L(保留2位有效数字,100.5≈ 3.2)。
)/c(Al3+)≥10,且调节并维持滤液pH=5.5,则其中HF平衡浓度应不低于______mol/L(保留2位有效数字,100.5≈ 3.2)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A.用惰性电极电解 Na2SO4溶液,当 2 mol电子转移时,可加入 18 g 水恢复
B.用惰性电极电解 CuSO4溶液,当加入1 mol Cu(OH)2恢复电解前浓度时,电路中转移了4mol e-
C.将Mg、Al金属放在NaOH溶液中组成原电池,Mg做负极,Al做正极
D.要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.用Cu片作阳极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用两个铜片作电极电解AgNO3溶液:Cu+2Ag+![]() 2Ag+Cu2+
2Ag+Cu2+
C.用石墨作电极电解FeCl3溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用石墨作电极电解CuBr2溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应。某小组设计实验制备氮化锂并测定其纯度,装置如图所示:
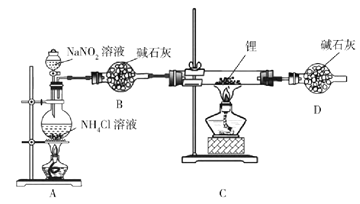
实验室用NH4Cl溶液和NaNO2溶液共热制备N2。
(1)盛装NH4Cl溶液的仪器名称是___________。
(2)安全漏斗中“安全”含义是__________。实验室将锂保存在_____(填“煤油”“石蜡油”或“水”)中。
(3)写出制备N2的化学方程式__________。
(4)D装置的作用是____________。
(5)测定Li3N产品纯度:取mg Li3N产品按如图所示装置实验。
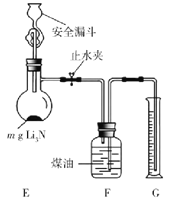
打开止水夹,向安全漏斗中加入足量水,当Li3N完全反应后,调平F和G中液面,测得NH3体积为VL(已折合成标准状况)。
①读数前调平F和G中液面的目的是使收集NH3的大气压________(填“大于”“小于”或“等于”)外界大气压。
②该Li3N产品的纯度为________%(只列出含m和V的计算式,不必计算化简)。若 Li3N产品混有Li,则测得纯度_____________(选填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究。查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐。
该小组同学利用下图装置进行实验(部分夹持仪器略)。
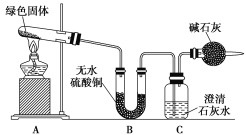
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)绿色固体中含有的元素是________________________________________________。
(2)加热后试管中剩余的黑色物质是_________________________________________________。
(3)假设该绿色物质是一种纯净物,则其化学式可能是______________,加热分解的化学方程式为_______________________________________________________________________________________。
(4)上述实验步骤③中的反应的离子方程式为________________________________________。
(5)实验装置最后的干燥管的作用是___________________________________________________。
(6)如果将B、C两装置对调,能否达到实验目的______(填“能”或“不能”),为什么?_____________________________________________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有以异丁烯为原料合成某二酸的合成路线如图:
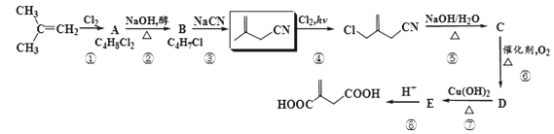
已知:R-CH2CN![]() R-CH2COONa+NH3
R-CH2COONa+NH3
(1)A的系统命名是__,B的官能团名称__。
(2)步骤③的反应类型是__。
(3)同一有机物中的两个同种官能团在反应时,一者参与反应占绝大多数,另一者几乎不反应,这被称之为“位置专一性”。请从反应物结构角度,简要解释步骤②中消去氯原子时的位置专一性:__。
(4)步骤⑤的产物C经酸化后,可发生分子内酯化,写出该内酯的结构简式___。
(5)写出步骤⑥的化学方程式__。
(6)均符合下列条件B的同分异构体为__。
a.所有碳原子一定共平面;b.核磁共振氢谱有3组峰。
(7)利用题目给的信息,写出由异丁烯为原料,两步合成![]() 的路线流程___。
的路线流程___。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近美国学者成功实现用氮气和水生产氨,其装置如下图所示:
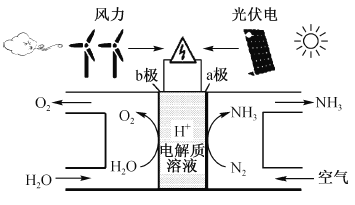
下列说法正确的是
A. 上图中的能量转化方式只有2种
B. a极发生的电极反应为N2 + 6H+ + 6e- = 2NH3
C. 装置工作时H+ 向b极区移动,电解质溶液pH减小
D. a极区与b极区产生的气体的物质的量之比为1 :1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com