
科目: 来源: 题型:
【题目】下列解释对应事实的离子方程式正确的是
A.FeSO4溶液中滴加NaOH溶液,静置一段时间后:Fe2++2OH一=Fe(OH)2↓
B.漂白粉溶液加入醋酸:H++ClO-=HC1O
C.AgCl悬浊液滴入Na2S溶液:2Ag++S2-=Ag2S↓
D.K2 CrO4溶液滴入硫酸溶液;2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】碲是发展高科技产业、国防与尖端技术不可或缺的原料。H2TeO3是一种比草酸酸性弱的二元酸,工业上常用铜阳极泥[主要成分是碲化亚铜(Cu2Te),含少量的Ag、Au]回收碲,其工艺流程如下:
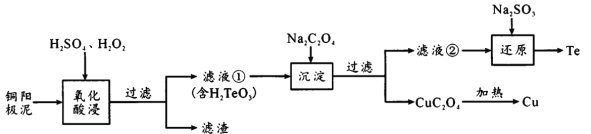
已知:CuC2O4的Ksp为2.2×10-8;离子浓度小于1×10-5mol/L时,即离子完全沉淀。
(1)Cu2Te中Te的化合价是___。
(2)滤渣的成分是___,滤液①中含有的氧化酸浸时氧化产物为____。氧化酸浸时温度过高会使碲的浸出率降低,原因是_______。
(3)若要使Cu2+完全沉淀,应控制C2O42-的浓度不低于_____。
(4)还原反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】将盛有14 mL由二氧化氮和氧气组成的混合气体的量筒倒立于水槽中,充分反应后剩余4 mL气体(相同状况下测定),原混合气体中二氧化氮和氧气的体积分别是多少?____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)①H2(g)+![]() O2(g)= H2O(l) △H= —285.8 kJ/mol
O2(g)= H2O(l) △H= —285.8 kJ/mol
②H2(g)+![]() O2(g)= H2O(g) △H= —241.8kJ/mol
O2(g)= H2O(g) △H= —241.8kJ/mol
③C(s)+![]() O2 (g) = CO (g) △H= —110.5kJ/mol
O2 (g) = CO (g) △H= —110.5kJ/mol
④C(s)+ O2 (g) = CO2 (g) △H= —393.5kJ/mol
回答下列问题:
上述反应中属于放热的是_________;H2的燃烧热为________;C的燃烧热为_____;
(2)汽油的重要成分是辛烷(C8H18),1 mol C8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518 kJ热量。请写出此反应的热化学方程式___________
(3)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化成液态水时放热2.444kJ,试写出氢气的燃烧热的热化学方程式________
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组进行如下实验:
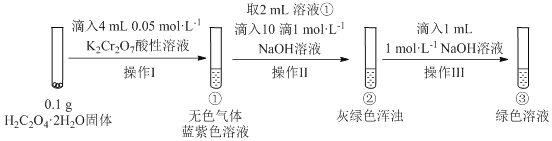
已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。下列关于该实验的结论或叙述不正确的是
A.①中生成蓝紫色溶液说明K2Cr2O7在反应中表现了氧化性
B.操作II中仅发生反应:Cr3++3OH-═Cr(OH)3↓
C.将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
D.若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明,在催化剂a(或催化剂b)存在下,CO2和H2能同时发生两个平行反应,反应的热化学方程式如下:
① CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g) ΔH1= - 53.7 kJ/mol
CH3OH(g)+ H2O(g) ΔH1= - 53.7 kJ/mol
② CO2(g)+ H2(g)![]() CO(g)+ H2O(g) ΔH2= + 41.2 kJ/mol
CO(g)+ H2O(g) ΔH2= + 41.2 kJ/mol
某实验小组控制CO2和H2初始投料比为1∶2.2。在相同压强下,经过相同反应时间测得的实验数据如下:
实验编号 | T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
1 | 543 | 催化剂a | 12.3 | 42.3 |
2 | 543 | 催化剂b | 10.9 | 72.7 |
3 | 553 | 催化剂a | 15.3 | 39.1 |
4 | 553 | 催化剂b | 12.0 | 71.6 |
(备注)甲醇选择性:转化的CO2中生成甲醇的百分比。
下列说法不正确的是
A. 相同温度下,在该时刻催化剂b对CO2转化成CH3OH有较高的选择性
B. 其他条件不变,升高温度反应①中CO2转化为CH3OH平衡转化率增大
C. 其他条件不变,增大反应体系压强反应②中平衡常数不变
D. 反应①在无催化剂、有催化剂a和有催化剂b三种情况下能量示意图如下:

查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
I.(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_________。直到因加入一滴盐酸后,溶液由黄色变为橙色,即到达滴定终点。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
A 酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C 酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
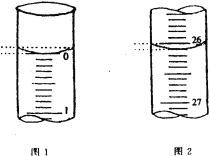
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为_________mL,终点读数为_____________mL;所用盐酸溶液的体积为______________mL。
(4)某学生根据三次实验分别记录有关数据如下表:
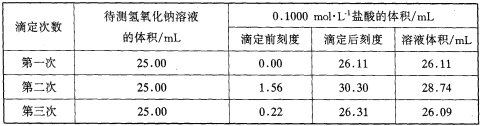
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度(保留4位小数):c(NaOH)______
II.有H+浓度相同、体积相等的三种酸:a、盐酸b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率_____________反应完全后生成H2的质量 ___________(用<、=、> 表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】I.(1)对于下列反应:2SO2 + O2 ![]() 2SO3 , 如果2min内SO2的浓度由8 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
2SO3 , 如果2min内SO2的浓度由8 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
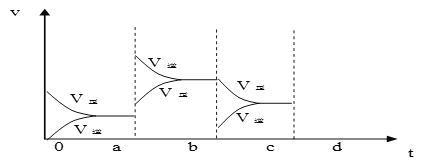
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是____________;b c过程中改变的条件可能是____________; 若增大压强时,反应速度变化情况画在c-d处__________.
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是____________;b c过程中改变的条件可能是____________; 若增大压强时,反应速度变化情况画在c-d处__________.
(3)对于下列电离平衡:NH3·H2O![]() NH4+ + OH -,能使c(NH4+)增大的措施是:_________
NH4+ + OH -,能使c(NH4+)增大的措施是:_________
①升高温度 ②加氨气 ③水 ④ NH4Cl溶液 ⑤NaOH溶液 ⑥适量的盐酸
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________;
(2)该反应为____________反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为____________℃;
(4)830℃时,向该容器中加入1LCO2与1LH2,平衡时CO2的体积分数是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com