
科目: 来源: 题型:
【题目】2020年1月南开大学周其林团队因《高效手性螺环催化剂的发现》获得国家自然科学一等奖。下面为两种简单碳螺环化合物,相关的说法正确的是

A.上述两种物质中所有碳原子处于同一平面
B.螺[3,3]庚烷的一氯代物有2种
C.螺[3,4]辛烷与3-甲基-1-庚烯互为同分异构体
D.![]() 的名称为螺[5,4]壬烷
的名称为螺[5,4]壬烷
查看答案和解析>>
科目: 来源: 题型:
【题目】PHB是一种树脂,有机物K是一种抗惊厥药物,它们的合成路线如下:
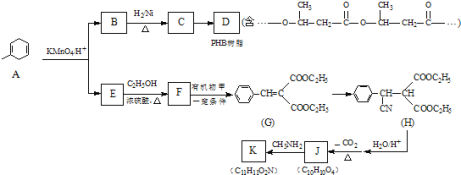
已知:R、R′、R″代表烃基
①RCN→H2O/H+RCOOH
②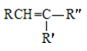
![]() RCOOH+
RCOOH+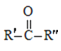
③
![]()
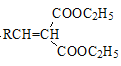 +H2O
+H2O
(1)B→C的反应类型是_____.
(2)写出一定条件下C→D的化学方程式_____:.
(3)有机物甲的结构简式为_____.
(4)写出E→F的化学方程式_____.
(5)已知1mol J最多与2mol NaHCO3反应;K分子结构中含有一个五元环与一个六元环.写出一定条件下J→K的化学方程式:_____.
(6)S是A的一种同分异构体,分子中没有环状结构,S的核磁共振氢谱有三个峰,峰面积之比为6:3:1,则S的结构简式为(写出一种即可)_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式书写正确的是( )
A. CaCO3的电离方程式:CaCO3 ![]() Ca2++CO32-
Ca2++CO32-
B. H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如下。
(1)实验1:用KCl作电解质,一定电压下,按图1装置电解,现象如下:石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。5 min后U型管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体,10 min后断开K.按图2进行实验。
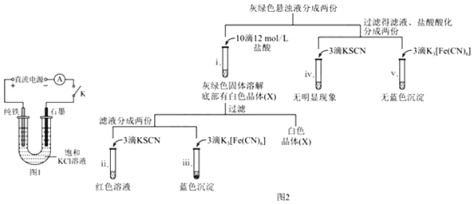
①石墨电极上的电极反应式是_____。
②确认灰绿色固体中含有Fe2+的实验现象是_____。
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色。结合平衡移动原理,解释“试管i中析出白色晶体”的原因是_____。
(2)实验2:其他条件不变时,用图3装置重复实验,10 min后铁电极附近溶液依然澄清,断开K,按图4进行实验
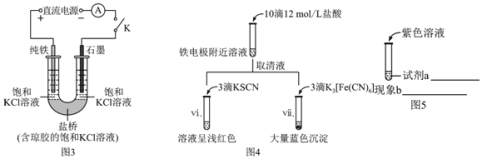
①结合图1和图2装置中现象的差异说明盐桥的作用是_____。
②对比图2和图4的现象,解释实验1和2中阳极附近实验现象不同的原因是:_____。
(3)实验3:用KOH作电解质
用图1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液逐渐变为淡紫色(![]() ),没有沉淀产生。
),没有沉淀产生。
①铁电极上OH-能够放电的原因是_____。
②阳极生成FeO![]() 的总电极反应式是_____。
的总电极反应式是_____。
③某同学推测生成的必要条件是浓碱环境,将图5中的实验方案补充完整,证实推测成立。试剂a:_____、现象b:_____。
(4)根据上述实验,“铁作阳极”时发生反应的多样性与_____有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】取m克铁粉与1 L 1.2 mol/L的稀HNO3恰好完全反应,反应后的溶液中只含Fe2+且硝酸的还原产物只有NO。则:
(1)m=______________g。
(2)若将反应后的溶液低温蒸干,析出晶体135 g,则析出晶体的组成可能是_________。
a.Fe(NO3)27H2O和Fe(NO3)24H2O
b.Fe(NO3)27H2O和Fe(NO3)2H2O
c.Fe(NO3)24H2O和Fe(NO3)2H2O
(3)若向反应后的溶液中加入100 mL 1.5 mol/L的稀H2SO4,则标准状态下还能产生NO的体积为______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】将32.0g铜与60.0mL一定浓度的硝酸发生如下反应:Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O。铜完全溶解产生的混合气体体积为8.96L(标况)。请计算(各数据保留两位有效数字):
(1)NO的体积为______
(2)该混合气体的平均摩尔质量约为______
(3)待产生的气体全部释放后,向溶液加入100mL 2.0mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ/mol
C(石墨)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为____;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为_;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:_____;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是_____(填序号)
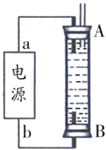
A.电源中的a一定为正极,b一定为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
H2O | CO | CO2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 0.4 | 3 |
3 | 900 | 1 | 2 | 0.4 | 1 |
①该反应的正反应为_____(填“吸”或“放”)热反应;
②实验2中,平衡常数K=_____;
③实验3跟实验2相比,改变的条件可能是_____(答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物数量众多,分布极广,与人类关系非常密切。
(1)石油裂解得到某烃A,其球棍模型为![]() ,它是重要的化工基本原料。
,它是重要的化工基本原料。
①A的结构简式为_________,A的名称是____________。
②A与溴的四氯化碳溶液反应的化学方程式为_______________。

③A→C的反应类型是____,C+D→E的化学方程式为_______,鉴别C和D的方法是_______。
④A的同系物B的相对分子质量比A大14,B的结构有____种。
(2)生苹果肉遇碘酒变蓝,熟苹果汁能与银氨溶液反应,苹果由生到成熟时发生的相关反应方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸亚铁可用作媒染剂、分析试剂、催化剂等。
(1)硝酸亚铁可用铁屑在低温下溶于稀硝酸制得,还原产物为NO。反应的化学方程式为________。
(2)某小组为探究硝酸亚铁晶体的热分解产物,按下图所示装置进行实验。
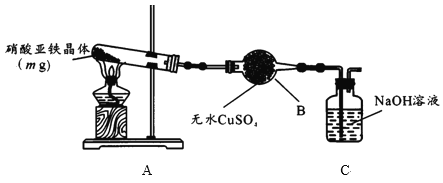
①仪器B的名称是____,实验中无水CuSO4变蓝,由此可知硝酸亚铁晶体含有___。
②实验中观察到A装置的试管中有红棕色气体生成,检验热分解后固体为氧化铁的实验方案为:
实验步骤 | 现象 |
取少量固体加适量稀硫酸,振荡,将溶液分成两份 | 固体溶解得黄色溶液 |
一份滴入____ | 溶液变成红色 |
另一份滴入1~2滴K3 [Fe(CN)6]溶液 | ___________ |
A中硝酸亚铁晶体[Fe(NO3)2·xH2O]分解的化学方程式为______ 。
(3)继续探究mg硝酸亚铁晶体中铁元素的质量分数
①取A中热分解后的固体放入锥形瓶,用稀硫酸溶解,加入过量的KI溶液,滴入2滴___作指示剂。
②用a mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至终点时用去bmLNa2S2O3溶液,则硝酸亚铁晶体中铁的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中AlN的质量分数。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
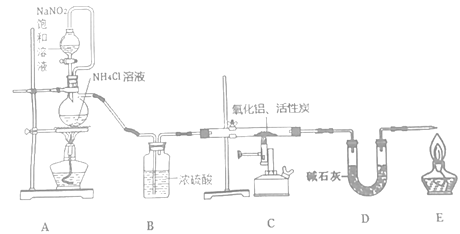
回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃___(“A”、“C”或“E”)处的酒精灯或酒精喷灯。
(2)装置A中发生反应的离子方程式为___,装置C中主要反应的化学方程式为___,制得的AlN中可能含有氧化铝、活性炭外还可能含有___。
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是___(写出一种措施即可)。
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为___。
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com