
科目: 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:![]()
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:![]()
D.最高价氧化物的水化物的酸性:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
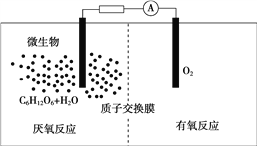
A. 微生物促进了反应中电子的转移
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物X(只含两种短周期元素)是一种重要的还原剂。某同学取X做了如下实验
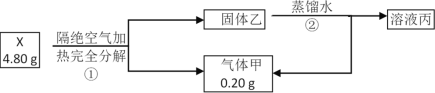
请回答:
(1)X的电子式是____________
(2)固体乙所含元素在元素周期表中的位置____________。
(3)写出X与水反应的化学方程式____________。
(4)X在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学利用下图装置测定CaCO3和稀盐酸反应的反应速率,开始时电子秤的示数为225.8 g,50 s后示数为223.6 g,则50 s内此反应的平均反应速率v(HCl)为(假定反应过程中溶液体积不变,且药品足量)( )
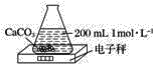
A.0.01 mol·L-1·s-1
B.0.05 mol·L-1·s-1
C.0.02 mol·L-1·s-1
D.0.1 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组探究潮湿的Cl2与Na2CO3反应的产物,进行如下实验根据设计要求回答:
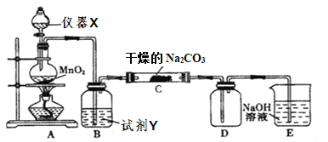
⑴X仪器名称是____________。
⑵装置A中发生反应的离子方程式:____________。
⑶B装置中试剂Y的作用是____________。
⑷下列有关该实验的说法中,不正确的是____________。
A.如图组装好实验仪器后,要先检查装置气密性,后添加药品
B.E装置的作用是吸收尾气防止污染空气
C.装置C中Cl2与Na2CO3以等物质的量反应,且生成的气体产物仅为Cl2O,可知反应方程式为2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O↑
D.试剂Y是浓硫酸,目的是干燥氯气
⑸设计实验方案验证C中生成的固体中存在![]() ____________。
____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸铜[(CH3COO)2Cu·H2O](其相对式量为200)常用作分析化学的分析试剂,还用作有机合成催化剂、瓷釉颜料等。可以用碱式碳酸铜与醋酸作用来制备。
实验步骤:
(I)碱式碳酸铜的制备

(Ⅱ)醋酸铜的制备
碱式碳酸铜与醋酸反应制得醋酸铜:
Cu(OH)2·CuCO3+4CH3COOH=2(CH3COO)2Cu·H2O+CO2↑+H2O
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量醋酸至固体不再溶解,趁热过滤。滤液在通风橱下蒸发至原体积的![]() 左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
回答下列问题:
(1)步骤(ⅰ)将研磨后混合物注入热水中反应,写出离子反应方程式______。
(2)碱式碳酸铜的制备需在热水中进行反应,且温度需控制在60℃左右,请解释原因______。
(3)在步骤(ⅰ)与步骤(ⅱ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤、趁热过滤与减压过滤,下列装置中没有使用到的有______。
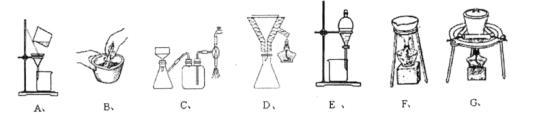
(4)步骤ⅱ中洗涤晶体的具体操作是______。
(5)最终称量所得的产品为8.0g,则产率为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是氢氧燃料电池的示意图,按图中提示,下列叙述不正确的是( )

A. a电极是负极,b电极是正极
B. a电极的电极反应式为H2-2e-===2H+
C. b电极的电极反应式为4OH--4e-===2H2O+O2↑
D. 氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内
查看答案和解析>>
科目: 来源: 题型:
【题目】300mL某溶液中可能含有Na+、NH4+、Mg2+、Ba2+、CO32-、SO42-、Cl-中的若干种,现将此溶液分成三等份,进行如下实验:
①向第一份中加入AgNO3溶液,有白色沉淀产生;
②向第二份中加足量KOH溶液并加热,收集到气体0.04 mol;(铵盐与碱共热可产生氨气)
③向第三份中加足量BaCl2溶液,得到沉淀6.27g,加入足量盐酸充分反应后,剩余沉淀2.33g。根据上述实验,回答下列问题:
(1)实验③中生成沉淀的离子方程式为________,沉淀溶解的离子方程式为__________。
(2)溶液中一定不存在的离子有_________。
(3)实验①中加入AgNO3溶液,有沉淀产生,能否说明原溶液中含有Cl-?________(填“能”或“否”)理由是______________。
(4)推断钠离子是否存在并说明理由_________。若存在,计算其物质的量的浓度____________(若不存在,此问不作答)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com