
科目: 来源: 题型:
【题目】硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应制得3SiH4+4NH3![]() Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
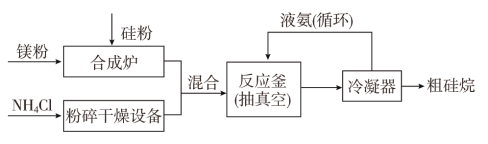
反应原理:4NH4Cl+Mg2Si![]() 4NH3↑+SiH4↑+2MgCl2(ΔH<0)
4NH3↑+SiH4↑+2MgCl2(ΔH<0)
①NH4Cl中的化学键类型有________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是____________________________。
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式:___________________________________________________,实验室可利用如图所示装置完成该反应。
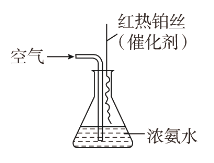
在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可作抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为________________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol/L盐酸中,充分反应后,滤去沉淀,用0.1 mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中的n值为________。(注:Mg2Si3O8的摩尔质量为260 g/mol)
查看答案和解析>>
科目: 来源: 题型:
【题目】邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一。
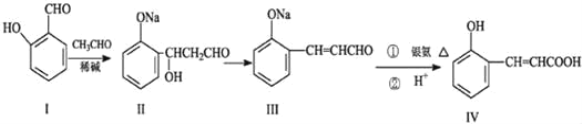
试回答:
(1)Ⅰ中官能团的名称______。
(2)Ⅱ→Ⅲ的反应类型______。
(3)①IV与乙醇在浓硫酸作用下发生酯化反应的方程式______。
②Ⅳ与过量NaOH溶液反应的化学方程式______。
(4)有机物X与IV互为同分异构体,且X有如下特点:
①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出X的两种结构简式_______;
(5)下列说法正确的是_______。
A.Ⅰ的化学式为C7H8O2
B.Ⅰ遇氯化铁溶液呈紫色
C.Ⅱ能与NaHCO3溶液反应
D.1mol有机物IV最多能与4molH2加成
查看答案和解析>>
科目: 来源: 题型:
【题目】某碱金属M及其氧化物(M2O)组成的混和物13.3g,加足量水充分反应后的溶液经蒸发结晶,得干燥固体16.8g,求该混和物的成分_________及其质量____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将0.2mol/LKMnO4酸性溶液0.1L与一定量pH=3的草酸(HOOC—COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.该反应释放CO2分子数目为![]() NA
NA
B.pH=3的草酸溶液含有H+数目为0.001NA
C.0.1molHOOC—COOH含共用电子对数目为0.9NA
D.当1molKMnO4被还原时,转移电子数为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香酸是分子中羧基与苯环直接相连的一类有机物,通常用芳香烃的氧化来制备。反应原理如下:
![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl
+HCl![]() +KCl
+KCl
反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水中的溶解性 |
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 |
主要实验装置和流程如图:
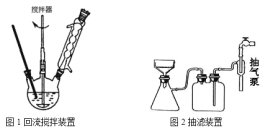
实验方法:一定量的甲苯和KMnO4溶液加入图1装置中,在90℃时,反应一段时间后,停止反应,按如图流程分离出苯甲酸并回收未反应的甲苯。
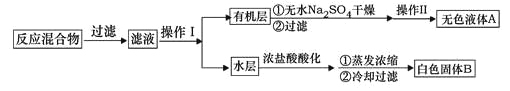
(1)白色固体B中主要成分的分子式为______,操作Ⅱ为______。
(2)下列关于仪器的组装或者使用正确的是______。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.如图回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是上进下出
(3)除去残留在苯甲酸中的甲苯应先加入______,分液,然后再向水层中加入______,抽滤,洗涤,干燥即可得到苯甲酸。
(4)纯度测定:称取2.440g产品,配成100mL溶液,取其中25.00mL溶液,行滴定,消耗KOH物质的量为4.5×10-3mol。产品中苯甲酸质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如图:

已知:①![]() +2H+
+2H+![]()
![]() +H2O ②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
+H2O ②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(l)浸取过程中提高浸取率的方法______(任写一种)
(2)钒渣中的V2O3与CaCO3混合后在空气中焙烧时转化为Ca(VO3)2同时释放出一种温室气体,写出该反应的化学方程式_____。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_____,浸出液中含钒物质的化学式为_________。
(4)过滤后用乙醇代替水来洗涤沉淀的原因是______。
(5)“沉钒”得到偏钒酸铵(NH4VO3),若浸出液中c(![]() )=0.1molL-1,为使钒元素的沉降率达到98%,至少应调节c(
)=0.1molL-1,为使钒元素的沉降率达到98%,至少应调节c(![]() )为_____molL-1[已知Ksp(NH4VO3)=1.6×10-3]
)为_____molL-1[已知Ksp(NH4VO3)=1.6×10-3]
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为_____。
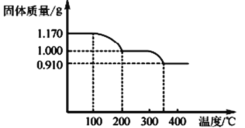
查看答案和解析>>
科目: 来源: 题型:
【题目】R元素无同位素。21gR2+金属离子内含有22×3.01×1023个中子,取等质量的该元素单质与酸反应,在标准状况下生成11.2LH2。
(1)21g R2+金属阳离子中含有_________mol质子?_________________mol电子?
(2)R是__________元素?写出该元素原子核的组成_______________?
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其分子式为C8H8O2,相对分子质量为136,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中不正确的是( )
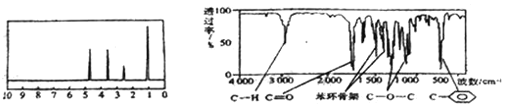
A.A分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与3molH2发生加成反应
C.符合题中A分子结构特征的有机物只有一种
D.与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的式量与X最最高价氧化物的式量之比为17∶ 40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,乙与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X__________、Y_________、Z__________。
(2)X离子的结构简图为____________________。X与Y形成的离子化合物的化学式为___________________,Z和氢形成的化合物的化学式为________________。
(3)Y单质在空气中燃烧的化学方程式为 __________________________________,生成物与水反应的化学方程式为_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数为114号的稳定同位素![]() X预测。
X预测。
(1)114X元素位于元素周期表第________周期____族,为________元素(“金属”、“非金属”)。
(2)其最高价氧化物及其对应水化物的分子式分别是____、____(用含X的式子表示),并估计后者为_______性(酸碱、两性)。
(3)它与氯生成化合物的分子式________、________(用含X的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com