
科目: 来源: 题型:
【题目】下表中各组物质之间不能通过一步反应实现如图转化的是
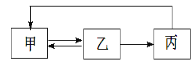
甲 | 乙 | 丙 | |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | NH3 | NO | HNO3 |
C | AlCl3 | Al(OH)3 | Al2O3 |
D | Cl2 | HCl | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下0.5mol![]() N3
N3![]() T分子中所含中子数为6.5NA
T分子中所含中子数为6.5NA
B.0.1molFe与0.1molCl2完全反应后,转移的电子数为0.2NA
C.13.35gAlCl3水解形成的Al(OH)3胶体粒子数小于0.1NA
D.一定条件下的密闭容器中,2molSO2和1molO2催化反应充分发生后分子总数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】以SO2、软锰矿(主要成分为MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4液和Mn3O4,主要实验步骤如下
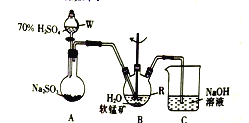
步骤I、如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2=MnSO4)。
步骤II、充分反应后,在不断搅拌下依次向仪器R中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅,
步骤III、过滤得MnSO4溶液
(1)仪器R的名称是_______。
(2)装置A用于制取SO2,反应的化学方程式为_________。
(3)装置B中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置C的作用是______________________。
(5)“步骤Ⅱ”中加入纯净MnO2的目的是_______________,用MnCO3调节溶液pH时,需调节溶液pH的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下表)
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀的pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的pH | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示

②反应温度超过80℃时,Mn3O4的产率开始降低,Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:______________________,真空干燥6小时得产品Mn3O4。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
①若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为________。
② 若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2﹣二甲基丁烷,则烃A的名称是_______,结构简式是______。
③比烃A少两个碳原子且能使溴水褪色的A的同系物有__种同分异构体
(2)下列分子中,其核磁共振氢谱中只有一种峰(信号)的物质是_____。
A. CH3﹣CH3 B. CH3COOH C. CH3COOCH3 D. CH3COCH3
(3)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图1所示,则A的结构简式为_______。
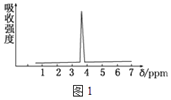
(4)某化合物的结构式(键线式)及球棍模型如图2:该有机分子的核磁共振氢谱图如图3(单位是ppm) 。下列关于该有机物的叙述正确的是_______。

A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香族化合物,且属于酚
C. 键线式中的Et代表的基团为﹣CH3
D. 该有机物在一定条件下能够发生消去反应
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)相同质量的CO和CO2,它们所含的原子数之比为___________,标准状况下,含有相同氧原子数的CO和CO2的体积之比为_____________。
(2)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(3)标准状况下有①0.112 L水 ②0.5NA个HCl分子 ③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol Ne 所含原子个数从大到小的顺序为___________。
(4)V mL Fe2(SO4)3溶液中,含有Fe 3+ m g,取出![]() mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修5:有机化学基础]化合物J是制备降血脂药贝利贝特的中间体,制备J的一种合成路线设计如下:
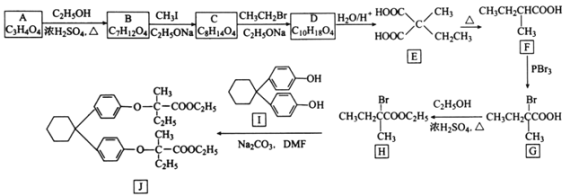
回答下列问题:
(1)A的化学名称是________________。
(2)G生成H的反应类型是________________;J的分子式为________________。
(3)C的结构简式为________________________。
(4)化合物I可由芳香化合物C6H6O和环状化合物C6H10O在醋酸和盐酸催化下制备得到,该反应的化学方程式为________________________________________。
(5)R与E互为同分异构体且与E具有相同的官能团种类和数目,则R的结构有________种。其中对应的核磁共振氢谱图中有四组峰,且峰面积比为4:3:2:1的结构简式为________。
(6)苯氧乙酸乙酯(![]() )是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
)是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)戊烷的某种同分异构体只有一种一氯代物,试书写它的结构简式_______
(2)某炔烃和氢气充分加成生成2,5﹣二甲基己烷,该炔烃的结构简式是_______
(3)某芳香烃结构为![]() 。它一氯代物有_______种。
。它一氯代物有_______种。
(4)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为_______,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_______。
(5) 分子式为C8H10的芳香烃,苯环上的一氯代物只有一种,该芳香烃的结构简式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |
查看答案和解析>>
科目: 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目: 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com