
科目: 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。

(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能说明SiO2为酸性氧化物的事实为( )
A.SiO2与H2SO4、HNO3不反应B.SiO2+4HF=SiF4↑+2H2O
C.SiO2+2KOH=K2SiO3+H2OD.SiO2+2C![]() Si+2CO↑
Si+2CO↑
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物K是某药物的合成中间体,其合成路线如图所示:
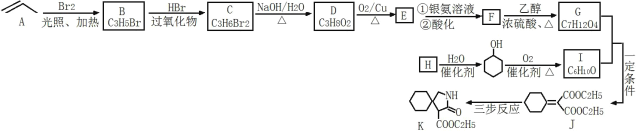
已知:HBr与不对称烯烃加成时,在过氧化物作用下,则卤原子连接到含氢较多的双键碳上;
请回答下列问题:
(1)C的化学名称为____,J中官能团的名称是____;
(2)H→![]() 的原子利用率为100%,则H的结构简式为____;
的原子利用率为100%,则H的结构简式为____;
(3)C→D的化学方程式为____;
(4)E与足量的Ag(NH3)2OH溶液反应的化学方程式为____;
(5)L是G的同分异构体,则满足下列条件的L的结构简式为____(任写一种结构即可)。
①lmol L与足量的NaHCO3溶液反应能生成2molCO2;
②L的核磁共振氢谱有3组峰且峰面积之比为1︰2︰3。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
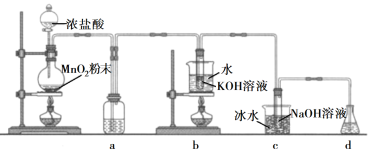
回答下列问题:
(1)盛放MnO2粉末的仪器名称是________,a中的试剂为________。
(2)b中采用的加热方式是_________,c中化学反应的离子方程式是________________,采用冰水浴冷却的目的是____________。
(3)d的作用是________,可选用试剂________(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,________,__________,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力____NaClO(填“大于”或“小于")。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙苯是重要的化工原料,利用乙苯为初始原料合成高分子化合物J的流程如图所示(部分产物及反应条件已略去):

已知:①R1CHO+R2CH2CHO![]() +H2O
+H2O
②
请回答下列问题:
(1)物质B的名称为____;F的结构简式为____;
(2)②、③的反应类型分别为____、____;
(3)物质H中官能团的名称是____;
(4)反应④的化学方程式为____;
(5)与G互为同分异构体,符合下列条件的芳香族化合物共有____种;
ⅰ.遇FeCl3显紫色
ⅱ.含碳碳叁键
(6)参照上述合成路线和信息,设计![]() 、乙醛、苯甲醇为原料合成
、乙醛、苯甲醇为原料合成 的路线(无机试剂任选)____。
的路线(无机试剂任选)____。
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:
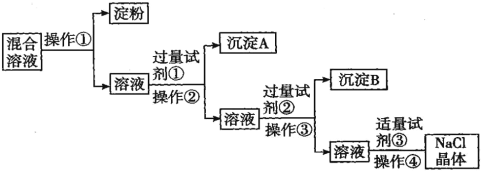
(1)操作①的名称是___________
(2)试剂①的化学式是____________ 判断试剂①已过量的方法是:________________________
(3)加入试剂②发生的离子方程式是____________________________________。
(4)操作④的名称是:_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
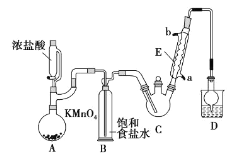
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
回答下列问题:
(1)仪器E的名称是____,冷凝水的流向是____口进水(填“a”或“b”)。
(2)有同学认为该装置存在一处缺陷,应在BC之间加一干燥装置,理由是____。
(3)该装置C控制反应温度在70℃左右,可采用____加热的方法;
(4)装置D干燥管的作用为____,装置D烧杯中的试剂是____。
(5)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是(填名称)____。
查看答案和解析>>
科目: 来源: 题型:
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。如图1装置是用燃烧法确定有机物分子式常用的装置。
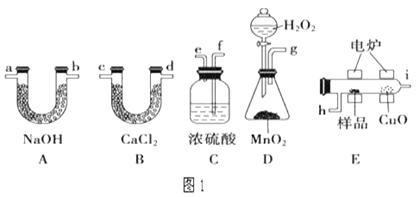
(1)燃烧管中CuO的作用是_____。
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取1.48g样品,经充分反应后,A管质量增加3.52g,B管质量增加1.8g,则该样品的实验式为_____。
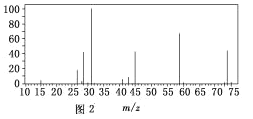
(3)用质谱仪测定其相对分子质量,得如图2所示的质谱图,则该有机物的相对分子质量为_____。
(4)若只根据A的实验式能否确定其分子式____(填“能”或“不能”)。
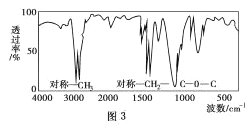
(5)该物质的红外光谱图如图3所示,则其结构简式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是______。根据对角线规则,B的一些化学性质与元素______的相似。
(2)NH3BH3分子中,N—B化学键称为____键,其电子对由____提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+![]() +9H2,
+9H2,![]() 的结构如图所示:
的结构如图所示: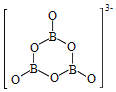 ;在该反应中,B原子的杂化轨道类型由______变为______。
;在该反应中,B原子的杂化轨道类型由______变为______。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________。与NH3BH3原子总数相等的等电子体是_________(写分子式),其熔点比NH3BH3____________(填“高”或“低”),原因是在NH3BH3分子之间,存在____________________,也称“双氢键”。
(4)研究发现,氦硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
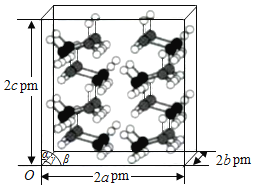
氨硼烷晶体的密度ρ=___________g·cm3(列出计算式,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
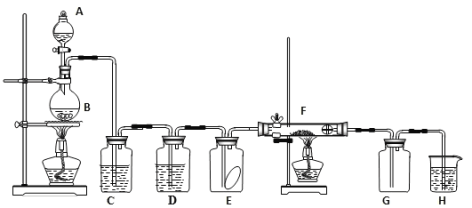
(1)装置C中盛装的溶液是____________,D中试剂的作用是____________________。
(2)E中的红色布条是否褪色?____(填“是”或“否”),写出F中反应的化学反应方程式:____________________,其反应现象为__________________________。
(3)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式为_________________________。
(4)8.7gMnO2固体与足量浓盐酸充分反应,在标准状况下产生Cl2的体积为_____L;其中被氧化的HCl的物质的量为_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com