
科目: 来源: 题型:
【题目】如图是元素M的价类二维图。其中A是一种盐,E的相对分子质量比D的相对分子质量大16,A和B是含最低价M元素的两种化合物,当x为一种强碱时,有如下转化关系。下列说法不正确的是( )
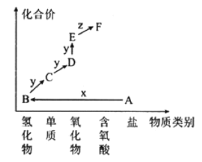
A.物质B遇少量的氯气会产生白烟
B.F的浓溶液可以用铁制容器盛放
C.E与水反应可生成F
D.物质D能够被x完全吸收
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸盐被广泛用作肥料和氧化剂。有学者最新研究发现氮在ZnFe0.4Co1.6O4上直接电化学氧化可生成硝酸盐。回答下列问题:
(1)Fe、Co、Ni均位于元素周期表第_________族,其中基态Ni原子的核外电子排布式为_________;Zn与Co的第一电离能I1(Zn)__________(填“<”或“>”)I1(Co)。
(2)图1是一种钴(Co)金属催化剂的结构,其中六元环上的N原子的杂化方式为_________;NH3、PH3中沸点更高的是_________,原因是_____________________________________。
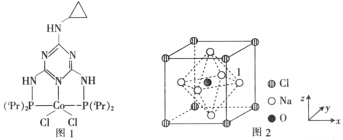
(3)一种由O、Na、C1元素构成的良好的离子导体,具有反钙钛矿晶体结构(如图2),则其化学式为_______________________,设其晶胞边长为anm,NA为阿伏加德罗常数的值,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有_______个,该晶胞的密度为_________________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中不正确的是( )
A.第ⅠA族的金属元素是同一周期中金属性最强的元素
B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
D.主族元素原子的最外层电子数不一定等于该元素的最高正化合价
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员研究了在Cu—ZnO—ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H)。下列说法错误的是

A.二氧化碳加氢制甲醇的过程中原子利用率小于100%
B.带*标记的物质是该反应历程中的中间产物
C.Cu—ZnO—ZrO2可提高甲醇的产率
D.第④步的反应式为*HO+*H→H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1
②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大
③具有相似的化学性质,都是活泼金属
④都具有强还原性,在化合物中显![]() 价
价
⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④B.①③⑤C.②④⑤D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】如果发现了原子序数为114的元素,下列对它的叙述中正确的是( )
①位于第七周期②非金属元素③最外电子层有4个电子④没有放射性⑤属于第IVA族元素⑥属于锕系元素.
A.①③⑤B.②⑥C.①③⑥D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3kJ·mol-1,②H2(g)+![]() O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1,下列有关说法正确的是( )
O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1,下列有关说法正确的是( )
A.向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
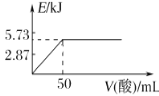
B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
C.氢气的燃烧热为 ΔH=-241.8kJ·mol-1
D.氢气的燃烧热为 ΔH=-483.6kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知草酸(H2C2O4)为二元弱酸,25℃时,Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5。用NaOH溶液滴定草酸氢钾(KHC2O4)溶液,混合溶液的相对导电能力随加入NaOH体积的变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列有关描述中正确的是
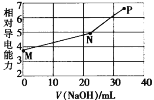
A.M点粒子浓度:c(K+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4)
)>c(H2C2O4)
B.N点时存在:c(Na+)+c(K+)<2c(![]() )+2c(
)+2c(![]() )
)
C.从N点到P点的过程中溶液中一定存在:c(Na+)+c(H2C2O4)>c(![]() )
)
D.水的电离程度大小顺序:P>N>M
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目: 来源: 题型:
【题目】近代化学工业的基础是“三酸两碱”,早在我国古代就已经有人通过煅烧绿矾并将产生的气体溶于水中的方法制得硫酸,该法制备硫酸的过程中发生的主要反应如下:
反应Ⅰ:2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O↑;
反应Ⅱ:SO3+H2O=H2SO4。
下列说法正确的是
A.当生成标准状况下气体22.4L时,转移1mol电子
B.6.4gSO2中所含的质子数与6.4gSO3中所含的质子数相等
C.SO2、SO3的中心原子杂化类型不同
D.目前,工业上制硫酸的吸收阶段是采用浓硫酸吸收SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com