
科目: 来源: 题型:
【题目】由以下粒子结构示意图得出的结论正确的是( )

A.④表示的是阳离子
B.①③属于同种元素,②④属于同种元素
C.②④形成的化合物是Al2O3
D.①③的化学性质相似
查看答案和解析>>
科目: 来源: 题型:
【题目】①![]() 与
与![]() ;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷
;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷![]() ;④甲烷(CH4)与丙烷(C3H8)。
;④甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是______(填序号,下同)。
(2)互为同系物的是______。
(3)互为同分异构体的是______。
(4)互为同素异形体的是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式 ;
(2)浓硫酸的作用是: ;
(3)饱和碳酸钠溶液的主要作用是___ 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是________________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是__________。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组使用甲烷燃料电池(如图甲所示)作为SO2传感器(如图乙所示)的电源,检测空气中SO2的含量。下列说法错误的是( )
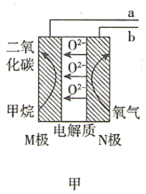
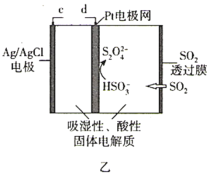
A.甲烷燃料电池M极的电极反应式为CH4-8e-+4O2-=CO2+2H2O
B.甲烷燃料电池的b端连接SO2传感器的c端
C.标准状况下,当甲烷燃料电池的N极消耗2.24L的O2时进入传感器的SO2为4.48L
D.每转移1mol电子,传感器中Ag/AgCl电极质量增加35.5g
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A.1L0.1mol/LNaHCO3溶液中,HCO3-和CO32-的总数0.1NA
B.由![]() 和
和![]() 组成的1molO2中,含有质子的数目为16NA
组成的1molO2中,含有质子的数目为16NA
C.标准状况下,22.4L的乙醇与足量的氧气反应,生成CO2的数目为2NA
D.2molSO2和1molO2于密闭容器内充分反应后,生成SO3的数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)基态Co原子核外电子占据________种不同的能级,其中有________个未成对电子。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ键的数目为________。
②C、N、O三种基态原子的第一电离能由大到小的顺序为________(用元素符号表示)。
③在相同的压强下,CO晶体的熔点高于N2晶体的原因为_______________________。
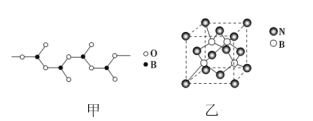
(3)BN晶体有多种结构,其中立方氮化硼具有金刚石型结构(如图乙)。
①晶体的最小环中含有________个B原子。
②若晶胞参数为anm,晶胞密度为ρg·cm-3,则阿伏加德罗常数的值可表示为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)在地壳中含量不大,但砷的化合物却丰富多彩。
(1)基态砷原子的电子排布式为________;砷与溴的第一电离能较大的是____________。
(2)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是________________________________________________________________。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为________,与其互为等电子体的一种分子为________。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为____________,As原子采取________杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似,GaAs晶体中,As与Ga之间存在的化学键有________(填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示分别为氯化钠、氯化铯、氟化钙的晶胞模型,请认真观察后完成表格。___________

离子晶体 | 晶体结构粒子 | 晶胞所含粒子数 | 配位数 | 阴阳离子个数之比 | ||
阴离子 | 阳离子 | 阴离子 | 阳离子 | |||
氯化钠 | ||||||
氯化铯 | ||||||
氟化钙 | ||||||
查看答案和解析>>
科目: 来源: 题型:
【题目】金属晶体的原子堆积方式常有以下四种,请认真观察模型(见图),回答下列问题:
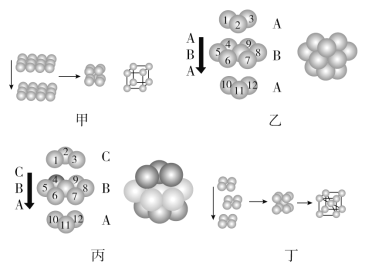
(1)四种堆积模型的堆积名称依次是________、________、________、________。
(2)甲堆积方式中的空间利用率为________,只有金属________采用这种堆积方式。
(3)乙与丙中两种堆积方式中金属原子的配位数________(填“相同”或“不相同”);乙中的空间利用率为________。
(4)采取丁中堆积方式的金属通常有________(任写三种金属元素的符号),每个晶胞中所含有的原子数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:__________。
②某元素原子的最外层电子数等于次外层电子数:__________________ 。
③L 层电子数是M层电子数2倍的元素: ___________________ 。
④某同位素原子核内没有中子的元素: ___________________ 。
(2)写出1~18号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。
①某元素原子L层上的电子数为K层的3倍: __________________ 。
②某元素原子L层上的电子数为K层的一半: _________________ 。
③得到2个电子后,电子总数与氩原子的电子总数相同的离子: ___________________ 。
④某元素原子的最外层电子数等于次外层电子数的2倍: ___________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com