
科目: 来源: 题型:
【题目】G 是合成抗新冠病毒药物的中间体,合成路线如图所示:
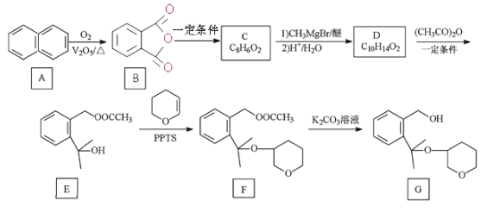
已知:R1COOR2![]()
 +R2-OH(R、R1、R2分别为烃基)
+R2-OH(R、R1、R2分别为烃基)
回答下列问题:
(1)G 中官能团的名称为____。
(2)C 的结构简式为____。
(3)写出 D 到 E 的方程式____,该反应类型为____。
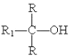
(4)标 出 F 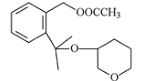 中的手性碳原子___。
中的手性碳原子___。
(5)H 与 G互为同分异构体,写出符合以下条件的一种结构简式____
①能发生水解反应;②核磁共振氢谱峰面积之比为 2:2:9:9
(6)已知RX![]() RMgX (X 表示卤素 原子) ,以苯甲醇 为原料制备
RMgX (X 表示卤素 原子) ,以苯甲醇 为原料制备 ,画出合成路线图___(无机试剂及有机溶剂任选)。
,画出合成路线图___(无机试剂及有机溶剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列图示所得出的结论一定错误的是
A. 表示酶催化反应的反应速率随反应温度的变化
表示酶催化反应的反应速率随反应温度的变化
B. 表示向Ba(OH)2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
表示向Ba(OH)2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
C. 表示用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸的滴定曲线
表示用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸的滴定曲线
D. 表示相同温度下,向等体积pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
表示相同温度下,向等体积pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是重要的化工原料,目前主要通过石油炼化制备。随着化石燃料资源日益减少,科研工作者正在探索和研发制备乙烯的新方法。
Ⅰ.甲烷在一定条件下脱氢可生成乙烯:2CH4(g)![]() C2H4(g)+2H2(g)△H>0
C2H4(g)+2H2(g)△H>0
(1)活化能Ea正____Ea逆(填“>”、“=”或“<”,下同);k正、k逆表示速率常数,当升高温度时,k正增大的倍数____k逆增大的倍数。
Ⅱ.利用生物无水乙醇催化脱水制备乙烯
主反应 i:C2H5OH(g)![]() C2H4(g)+H2O(g)△H1=+45.5 kJ/mol
C2H4(g)+H2O(g)△H1=+45.5 kJ/mol
副反应 ii:2C2H5OH(g)![]() C2H5OC2H5(g)+H2O(g)△H2=﹣19.0 kJ/mol
C2H5OC2H5(g)+H2O(g)△H2=﹣19.0 kJ/mol
副反应 iii:C2H5OC2H5(g)![]() 2C2H4(g)+H2O(g)△H3
2C2H4(g)+H2O(g)△H3
(2)求△H3=____。
(3)在 2L 恒容密闭容器中充入2mol C2H5OH(g)和一定量的催化剂进行反应,平衡体系中含碳组分的物质的量分数随温度的变化如图所示:
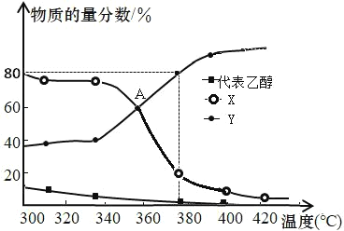
①图中 Y 代表____(填“C2H4”或“C2H5OC2H5”),请解释原因____。
②主反应 i 在 A 点达到平衡状态的标志为____。
a.乙烯浓度不再变化 b.容器内压强不随时间变化
c.混合气体的密度不随时间变化 d.△H 不再变化
③380℃时,假设乙醇完全反应,则反应 iii 的平衡常数 K=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】1797年法国化学家沃克兰从当时称为红色西伯利亚矿石中发现了铬,后期人类发现铬元素在其他方面有重要用途。
(1)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K____Cr (填“>”或“<”)。
(2)氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能,请写出Cr3+基态核外电子排布式为____;CrN 晶体类型与 NaCl 晶体相同,但前者熔点(1282℃)比后者(801℃)的高,主要原因是____。
(3)Cr3+可与很多分子或离子形成配合物, 如图配合物中 Cr3+的配位数为_________,配体中采取sp3杂化的元素是__________。
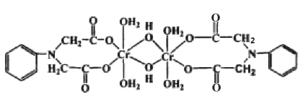
(4)铬的一种氧化物的晶胞结构如图所示,其中氧离子与晶体镁堆积方式一致,铬离子在其八面体空隙中(如:CrA在O1、O2、O3、O4、O5、O6 构成的八面体空隙中)。
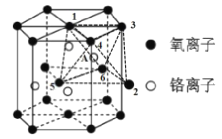
①该氧化物的化学式为 ______。
②该晶胞有 _____%八面体空隙未填充阳离子。
③已知氧离子半径a cm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为____g·cm-3(用含a、b和NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答下列问题:
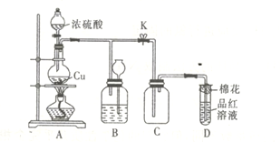
(1)装置A中发生反应的化学方程式为________________________。
(2)装置D中试管口放置的棉花应用一种液体浸泡一下,这种液体是_____,其作用是______。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭弹簧夹K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________________。B中应放置的液体是___(填字母)。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_______________________。
②下列药品中能用来证明反应结束后的圆底烧瓶中确有余酸的是_________(填字母)。
a.铁粉 b.BaC12溶液 c.银粉 d.Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2是有用的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组设计如下方案,在实验室条件下测定转化器的脱硫效率:
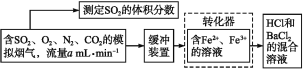
(1)写出Fe3+将SO2反应的离子方程式:__。
(2)若上述实验是在标准状况下进行的,欲测定转化器中的脱硫效率,现已测得气体流量和模拟烟气中SO2的体积分数,还需要测定的数据是___。
(3)向滴有紫色石蕊溶液的试管中通入SO2气体,现象是__;若再向其中滴入足量的氯水,现象是__,涉及反应的化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
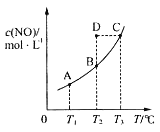
A.该反应的ΔH>0
B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2
C.在T2℃时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
查看答案和解析>>
科目: 来源: 题型:
【题目】浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。下列各项分别表现浓硫酸的什么性质,请将序号填于空白处:
(1)浓硫酸与食盐共热,浓硫酸表现的性质为__。
(2)浓硫酸与铜共热,化学方程式为__,浓硫酸表现的性质是__。
(3)浓硫酸与红热木炭反应,化学方程式为__,浓硫酸表现的性质是__。
(4)可用浓硫酸干燥H2、CO2、HCl等气体,浓硫酸表现的性质为__。
(5)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,浓硫酸表现的性质是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向二元弱酸H2Y溶液中滴加 KOH 溶液,所得混合溶液的 pH 与 P[P=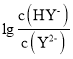 或
或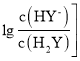 变化关系如图所示。下列说法正确的是
变化关系如图所示。下列说法正确的是
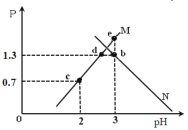
A.曲线 M 表示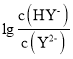 随 pH 的变化关系
随 pH 的变化关系
B.Ka2 的数值是10-6
C.e 点溶液中:2c(Y2-)+c(HY-)﹣c(K+)+c(OH-)=0.001mol·L-1
D.KHY 溶液中:c(K+)>c(HY﹣)>c(H+)>c(Y2-)>c(H2Y)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程。
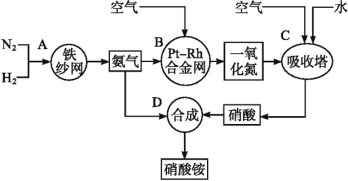
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:__。
(2)B装置中Pt-Rh合金网的作用是__,写出B中有关反应方程式:__。
(3)写出D中反应方程式:___。
(4)吸收塔C中通入空气的目的是___。A、B、C、D四个容器中的反应,属于氧化还原反应的是__(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com