
科目: 来源: 题型:
【题目】CO和H2可作为能源和化工原料,应用十分广泛。工业上可利用CO或CO2与H2反应来制备甲醇。
反应①:2H2(g)+CO(g)![]() CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g)△H=+41.2kJ·mol-1
H2O(g)+CO(g)△H=+41.2kJ·mol-1
(1)写出用CO2与H2反应制备甲醇的热化学方程式______________。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
升高温度,该平衡的移动方向是______________(填“正向”或“逆向”)。500℃时,CO和H2O的起始浓度均为0.020mol·L-1,该条件下CO的平衡浓度为:______________mol·L-1。
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示,该温度下的的平衡常数等于_______________。
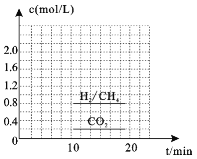
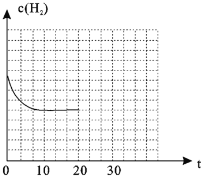
(4)若在20min时减小压强,并在30min时达到平衡状态,请在图2中画出H2的物质的量浓度随时间变化的图像__________________。
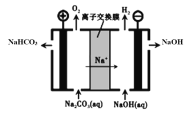
(5)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。请写出阳极的电极反应式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家提出用CO2置换可燃冰(mCH4·nH2O) 中CH4的设想,置换过程如图所示,下列说法正确的是
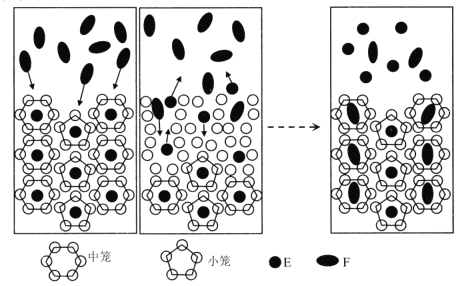
A.E代表CO2, F代表CH4
B.笼状结构中水分子间主要靠氢键结合
C.CO2置换出CH4的过程是化学变化
D.CO2可置换可燃冰中所有的CH4分子
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学取一定质量的铁铝合金与100 mLxmol/L稀硝酸充分反应,反应过程中没有气体放出。在反应结束后的溶液中,逐滴加入2 mol/L NaOH溶液,所加 NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示:
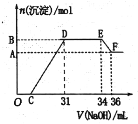
(1)写出EF段发生反应的离子方程式____________
(2)C点对应的溶液中含有的阳离子除Na+外,还含有_______。
(3)x =________。
(4)铁铝合金中铝的物质的量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如图的实验装置:
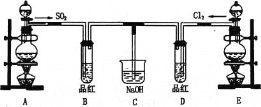
(1)实验室用装置A,用浓硫酸和铜反应制备SO2,请写出化学反应方程式____________
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B_____、D______,停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B_____、D______。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为________,检验溶液中还有Fe3+的试剂是_________。
(2)—定量的SO2与NaOH溶液反应,所得产物中含有Na2SO3和NaHSO3,物质的量之比为3:5,则参加反应的SO2与NaOH的物质的量之比为___________。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为_________。
(4)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中 CO和CO2物质的量之比为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备纯碱的主要步骤如流程所示:

四种盐在不同温度下的溶解度(g/100gH2O)表
温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
提示:温度高于35℃时NH4HCO3会分解,请回答:
(1)下列操作或描述正确的是________。
A.温度控制在30-35℃是因为温度太高NH4HCO3会分解,温度太低反应速率太慢
B.保温30min的目的是使反应充分进行
C.过滤后的滤液只有NH4Cl和NH4HCO3溶质
D.洗去晶体表面的杂质可以选用蒸馏水
(2)反应温度控制在30~35℃,为控制此温度范围,采取的加热方法为______________。
(3)常温时,过滤后主要得到NaHCO3晶体的原因是______________。
(4)灼烧NaHCO3晶体的装置为________。
A.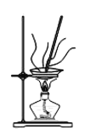 B.
B.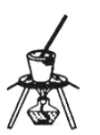 C.
C.
(5)洗涤NaHCO3晶体的操作______________。
(6)测定纯碱产品中NaHCO3含量的方法:准确称取纯碱样品Wg放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点)所用HCl溶液体积为V1mL。再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2mL,写出纯碱样品中NaHCO3质量分数的计算式:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物c的制备原理如下:
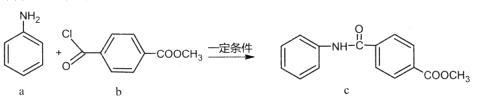
下列说法正确的是
A.该反应为加成反应B.化合物a中所有原子一定共平面
C.化合物C的一氯代物种类为5种D.化合物b、c均能与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某科研小组利用石油分馏产品合成一种新型香料的流程图如下。
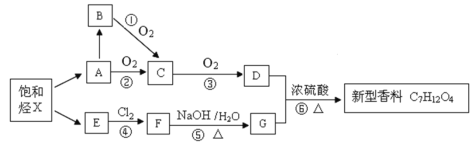
已知X分子中碳氢质量比为24∶5,X有多种裂解方式,其中A、E都是X的裂解产物,且二者互为同系物,D与饱和NaHCO3溶液反应产生气体。
信息提示:卤代烃在强碱水溶液中发生水解(取代)反应生成醇。如:R-CH2CH2Cl![]() RCH2CH2OH+HCl(水解反应)
RCH2CH2OH+HCl(水解反应)
(1)C中官能团的名称为______________。
(2)请写出X的直链结构简式______________。
(3)下列说法正确的是______________。
A.可用金属钠鉴别B和G
B.E在一定条件下与氯化氢发生加成反应的产物有2种
C.D和G以1:1反应可生成分子式为C5H10O2的有机物
D.E→F的反应类型为取代反应
(4)请写出A→B的反应______________。
(5)B与D在浓硫酸作用下生成甲,写出与甲同类别的同分异构体的结构简式______________(不包括甲)。
(6)写出⑥的化学反应方程式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠(Na2MoO4)是一种冷却水系统的金属缓蚀剂,工业上利用钼精矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如下图所示。
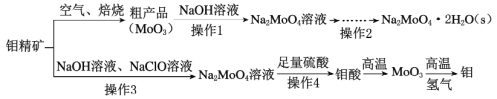
回答下列问题:
(1)如果在空气中焙烧1mol MoS2时,S转移12mol电子,则MoS2中钼元素的化合价为____;焙烧产生的尾气对环境的主要危害是___。
(2)若在实验室中进行操作2,则从钼酸钠溶液中得到钼酸钠晶体的操作步骤是_,过滤、洗涤、干燥。
(3)钼精矿中MoS2含量的测定:取钼精矿16g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体(Na2MoO4·2H2O)12.1g(假设各步的转化率均为100%),钼精矿中MoS2的质量分数为_________。(已知MoS2的相对分子质量为160,Na2MoO4·2H2O的相对分子质量为242)。
(4)操作3硫元素被氧化为最高价,发生反应的离子方程式为_______。
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图所示。b电极上的电极反应式为____________。
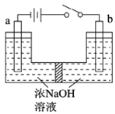
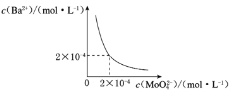
(6)某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图所示,该温度下BaMoO4的Ksp的值为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】—定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴 滴入某浓度稀盐酸,加入V(HC1)与生成n(CO2)的关系如图所示。下列有关叙述正确的是
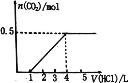
A.通入的CO2气体为11.2 L
B.A溶液中 n(NaHCO3) = 2n(Na2CO3)
C.A溶液中既含有NaOH,又含有Na2CO3
D.A溶液中可能含有NaOH和NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com