
科目: 来源: 题型:
【题目】绿原酸的结构简式如图,下列有关绿原酸的说法不正确的是
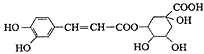
A.分子式为C16H18O9
B.能与碳酸钠溶液发生反应
C.能发生取代反应和消去反应
D.0.1 mol绿原酸最多与含0.6molBr2的浓溴水反应
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室在 500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示 (已知分解的固体产物可能有 FeO、Fe2O3 和 Fe3O4,气体产物可能有 NH3、N2、H2O、SO3 和 SO2)。下列说法正 确的是( )

A. 取①中固体残留物与稀硫酸反应并滴加 KSCN,溶液变红,则残留物一定为 Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂 X 最好选用碱石灰
C. 装置③用于检验分解产物中是否有 SO3 气体生成并除去 SO3 和 NH3
D. 装置④用于检验分解产物中是否有 SO2 气体生成,装置⑤用于收集生成的 NH3 和 N2
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数;______________
(2)混合后溶液的物质的量浓度;(保留到小数点后一位,下同)___________
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?__________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A.除去苯中的杂质苯酚可加入浓溴水后过滤
B.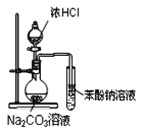 装置可证明酸性:盐酸>碳酸>苯酚
装置可证明酸性:盐酸>碳酸>苯酚
C.乙二酸与足量的酸性KMnO4溶液混合:5H2C2O4 + 2MnO4- + 6H+ =10CO2 ↑ + 2Mn2+ + 8H2O
D.鉴别![]() 和
和![]() 只能用金属钠
只能用金属钠
查看答案和解析>>
科目: 来源: 题型:
【题目】在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。已知:25℃H2S电离常数分别为Ka1=1.3×10—7,Ka2=7.0×10—15,某溶液含0.02mol/LMn2+、0.1mol/LH2S,向该溶液中通入HCl气体或加入NaOH固体以调节溶液pH,(忽略溶液体积的变化、H2S的挥发)。当溶液的pH=5时,Mn2+开始沉淀为MnS,则:
(1)HS—的电离常数表达式为______________;
(2)Na2S溶液中的微粒有_____________种;
(3)NaHS溶液的pH_____________7(填“>”、“=”或“<”),理由是__________________;
(4)当溶液的pH=5时,c(S2—)∶c(H2S)=______________;
(5)MnS的溶度积为_____________;
(6)当Mn2+完全沉淀时,溶液中c(S2—)=____________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。
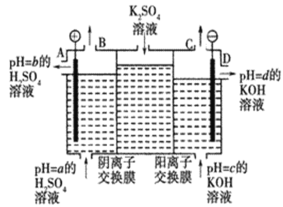
(1)该电解槽的阳极反应式为__________________________________,通过阴离子交换膜的离子数___________(填“>”“<”或“=”)通过阳离子交换膜的离子数
(2)图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为___________
(3)电解一段时间后,B口与C口产生气体的质量比为___________
Ⅱ.常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
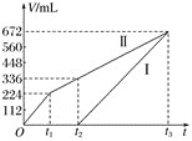
(1)曲线___________(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化
(2)CuSO4的物质的量浓度为___________mol/L
(3)t1时所得溶液恢复到原来状态需加___________(物质名称)质量___________g
(4)t2时所得溶液的pH为___________
查看答案和解析>>
科目: 来源: 题型:
【题目】某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.在FeOFeyCrxO3中,3x=y
B.处理废水中Cr2O72-的物质的量为![]() mol
mol
C.反应中发生转移的电子数为3nxmol
D.消耗硫酸亚铁铵的物质的量为n(2-x)mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲配制3.6 mol/L的H2SO4溶液80 mL,探究硫酸的性质。实验室有两种不同浓度的硫酸可供选用:① 25%的硫酸(ρ=1.18 g/mL);②98%的硫酸 (ρ=1.8 g/mL)。请回答下列问题:
(1)配制该硫酸溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外还有________;
(2)本实验需量取所选用硫酸的体积为____________________mL;
(3)下列操作会使得所配硫酸溶液浓度偏低的是____________
a.量取硫酸溶液的量筒未用蒸馏水洗涤
b.硫酸稀释后立即转移至容量瓶中
c.转移的时候不小心有少许洒到实验台上
d.定容摇匀时,液面下降又加水
e.定容时仰视刻度线
(4)取所配硫酸溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。试回答:如何证明溶液中的硫酸根离子沉淀完全?__________________________________;
(5)将100mL标号为②的浓硫酸与水(密度为1g/ml)混合,其质量分数为49﹪,则水的体
积________100mL(填“大于”、“小于”、“等于”或“无法确定”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色氧化剂,具有高效的杀菌消毒作用,常用于饮水处理,在许多领域展现出广阔的应用前景。制备高铁酸钾有下列两种方法:
方法一:Fe2O3 + KNO3 + KOH===== K2FeO4 + KNO2 + H2O (未配平)
方法二:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+ 5H2O
(1)配平方法一的化学方程式___,再用双线桥标明电子转移的方向和数目___:
___Fe2O3 +___KNO3 +___KOH == ___ K2FeO4 +___ KNO2 +___ H2O
(2)方法二中的还原产物为_________ (写化学式),将方法二的化学方程式改写为离子方程式 ________ ,根据反应方程式,氧化性:KClO ________ K2FeO4(填“>”、“<”或“=”);
(3)利用方法二制备K2FeO4,若有0.5mol K2FeO4生成,转移的电子数为___________ ;
(4)在酸性溶液中,某反应的反应物和生成物有KBiO3、K2SO4、H2SO4、MnSO4、H2O、Bi2(SO4)3 和一种未知物质M。
①已知MnSO4在反应中失去电子,则该反应的氧化剂是________;
②已知该反应中被氧化的元素与被还原的元素的物质的量之比为2:5,则M的化学式为______;
③写出该反应的离子反应方程式________;
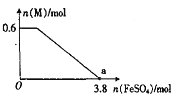
④某同学向上述反应后的溶液中逐滴加入FeSO4溶液,测得溶液中M的物质的量与FeSO4的物质的量之间的关系如图所示。已知氧化性:Fe3+>Bi3+,且a点时溶液中含Fe3+、Mn2+,则原反应体系中,起始加入的KBiO3的物质的量为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com