
科目: 来源: 题型:
【题目】①9.8g H2SO4的物质的量为______mol,约含有________个H2SO4 分子
②标准状况下,22.4LH2的质量为__________ g
③将30mL0.5mol/LNaCl溶液加水稀释到500mL,稀释后NaCl溶液的物质的量浓度为__________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4.考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
![]()
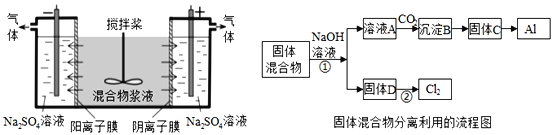
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)C→Al的制备方法称为电解法,请写出阳极反应方程式_____________________.
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2.由此判断影响该反应有效进行的因素有(填序号)_____。
A.温度 B.溶液的pH值 C.Cl-和![]() -的浓度
-的浓度
(3)固体D是碱性锌锰电池的正极,请写出该电池的负极反应方程式_____________ 。
(4)0.2molCl2与焦炭、TiO2完全反应,生成CO和TiCl4(熔点-25℃,沸点136.4℃)放热8.56kJ,该反应的热化学方程式为______________________________________.
Ⅱ.含铬元素溶液的分离和利用
(5)用惰性电极电解时,![]() 能从浆液中分离出来的原因是_________________,
能从浆液中分离出来的原因是_________________,
分离后得到的含铬元素的粒子有![]() ﹣和
﹣和![]() ﹣,原因是__________________________(用离子反应方程式表示),阴极室生成的物质为_____________(写化学式);
﹣,原因是__________________________(用离子反应方程式表示),阴极室生成的物质为_____________(写化学式);
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)又叫乙二酸,广泛存在于植物源食品中,25℃时,其解离常数Kal=5.9×10-2; Ka2= 6.4×10-5。下列与草酸有关的说法错误的是
A.H2C2O4(aq) H+(aq) +HC2O4-(aq) △H >0;升温有利于提高草酸的电离程度
B.草酸中的碳为+3价,具有较强的还原性,可使酸性高锰酸钾溶液褪色
C.25℃时,KHC2O4溶液呈弱酸性,有时用于清洗金属表面的锈迹
D.同浓度的KHC2O4和K2C2O4混合溶液中:2c( H2C2O4) +2c( HC2O4)+2c( C2O42-) =3c(K+)
查看答案和解析>>
科目: 来源: 题型:
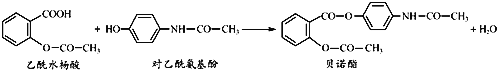
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
下列有关叙述正确的是
A.贝诺酯分子中有三种含氧官能团
B.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
C.乙酰水杨酸和对乙酰氨基酚均能与Na2CO3溶液反应放出CO2气体
D.可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室配制500 mL 0.2 mol/L的Na2SO4溶液,实验操作步骤有:
A.在天平上称出14.2 g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。
B.把制得的溶液小心地转移到容量瓶中。
C.继续向容量瓶中加蒸馏水至液面距刻度线1-2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶瓶塞塞紧,充分摇匀.请填写下列空白:
(1)操作步骤的正确顺序为(填序号)_________。
(2)本实验用到的基本仪器已有烧杯、天平托盘(带砝码、镊子)、玻璃棒,还缺少的仪器是_____、____、____。
(3)下列情况会使所配溶液浓度偏高的是(填序号)________。
a.某同学观察液面的情况如右图所示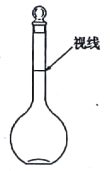
b.没进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的液态化合物XY2,在一定量的氧气中恰好完全燃烧,其化学方程式:XY2(l)+3O2(g)![]() XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56 g·L-1。
XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56 g·L-1。
(1)反应前氧气的体积是__________。
(2)化合物XY2的摩尔质量是__________。
(3)若XY2分子中X、Y两元素摩尔质量比是3∶16,则X、Y两元素分别为__________和__________(填元素符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室用NaClO4、NH4Cl等原料制取(部分物质的溶解度如图1、图2),其实验流程如图3:
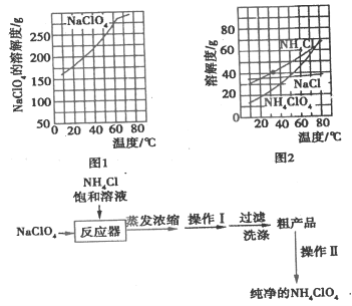
(1)反应器中发生反应的基本反应类型是________。
(2)上述流程中由粗产品获得纯净高氯酸铵的方法为________。
(3)洗涤粗产品时,宜用________(填“0℃冷水”或“80°C热水”)洗涤。
(4)已知NH4ClO4在400℃时开始分解为N2、Cl2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略)
实验开始前,已用CO2气体将整套实验装置中空气排尽;焦性没食子酸溶液用于吸收氧气。
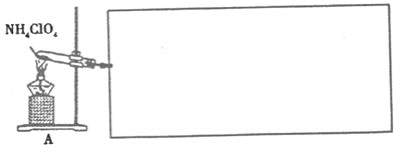
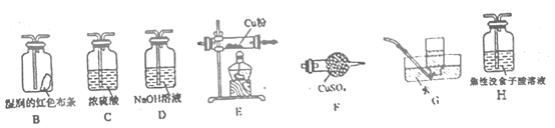
①写出高氯酸铵分解的化学方程式________。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→________(填装置对应的字母),证明氧气存在的实验现象为________。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生使湿润的红色石蕊试纸变蓝的气体。滴加蒸馏水发生反应的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,有刺激泩气味 |
Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程是________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是________ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是________。
④用下图装置(a、b均为石墨电极)进行实验V:

i. K闭合时,指针向左偏转
ⅱ. 向右管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针偏转幅度变化不大ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针向左偏转幅度增大
将i和ⅱ、ⅲ作对比,得出的结论是________。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸________(填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | …… |
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是________。
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、________有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )

下列图示与对应的叙述符合的是( )
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO2(g)+O2(g) ![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C.图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D.图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)Ⅰ.太阳能、风能发电逐渐得到广泛应用,在发电系统中安装储能装置有助于持续稳定供电,其构造的简化图如下

下列说法中,不正确的是________ (填字母序号)
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(2)全钒液流电池是具有发展前景的、用作储能系统的蓄电池。已知放电时V2+发生氧化反应,则放电时电极A的电极反应式为________ 。
(3)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+, Fe3+)等进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液pH范围不同时,钒的存在形式如下表所示
钒的化合价 | pH<2 | pH>11 |
+4价 | VO2+, VO(OH)+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①加入NaOH调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH后涉及到氧化物还原反应的化学反应方程式为________。
②向碱性的滤液1(V的化合价为+4)中加入H2O2的作用是________ 。
(4)Ⅱ.氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
![]()
Ⅰ中加入NaOH溶液,调pH=11并鼓入大量空气,用离子方程式表示加NaOH溶液的作用是________;鼓入大量空气的目的是________。
(5)Ⅱ中加入适量NaClO溶液,控制pH在6~7,将氨氮转化为无毒物质,过程Ⅱ发生3个反应:
ⅰ.ClO-+H+=HClO
ⅱ.NH4++HClO=NH2Cl+H++H2O(NH2Cl中Cl元素为+1价)
ⅲ. ……
已知:水体中以+1价形式存在的氯元素有消毒杀菌的作用,被称为“余氯”。下图为NaClO加入量与“余氯”含量的关系示意图。其中氨氮含量最低的点是c点。

b点表示的溶液中氮元素的主要存在形式是(用化学式表示) ________;反应ⅲ的化学方程式是________。
(6)Ⅲ中用Na2SO3溶液处理含余氯废水,要求达标废水中剩余Na2SO3的含量小于5mg·L-1。若含余氯废水中NaClO的含量是7.45mg·L-1,则处理10m3含余氯废水,至多添加10%Na2SO3溶液________kg(溶液体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com