
科目: 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙。下列有关物质的推断错误的是[已知Al3++3AlO2-+6H2O=4Al(OH)3↓]
丙。下列有关物质的推断错误的是[已知Al3++3AlO2-+6H2O=4Al(OH)3↓]
A.若甲为焦炭,则丁可能是O2
B.若甲为AlCl3溶液,则丁可能是KOH溶液
C.若甲为Cu,则丁可能是Cl2
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
![]()
A.原子半径Q>R>T
B.原子序数比R多1的元素只能形成一种氢化物
C.W原子得电子能力强于Q原子,且可形成共价化合物QW2
D.与W同一主族的下一周期元素不可作为半导体材料
查看答案和解析>>
科目: 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学活动小组设计以下装置进行不同的实验。其中a为用于鼓入空气的气囊,b 为螺旋状铜丝,c中盛有冰水。

(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是____________(填序号),该装置中应加入试剂____________。从实验安全角度考虑,A装置试管中除加入反应液外,还需加入的固体物质是____________。
(2)该小组同学欲做乙醇氧化成乙醛的实验,则应选用的装置是____________(填序号),再用制得的乙醛溶液进行银镜反应,正确的操作顺序是____________(填序号)。
①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管中加入1 mL 2%的AgNO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某芳香族酯类化合物甲的分子式为C14H10O5,1 mol甲水解后只生成一种产物乙,其物质的量为2 mol,下列说法正确的是( )
A. 符合上述条件的甲共有3种B. 1 mol甲最多可以和3 mol NaOH反应
C. 乙不能和溴水发生反应D. 2 mol乙最多可以和1 mol Na2CO3反应
查看答案和解析>>
科目: 来源: 题型:
【题目】乙偶姻是一个极其重要的香料品种,主要用于配制奶香型、肉香型、草莓香型香精,也可用于合成其他精细化学品。已知乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
请回答:
(1)乙偶姻的分子式为___________。
(2)X是乙偶姻的同分异构体,属于酯类,写出其结构简式(两种即可)_____________。
已知:
乙偶姻中含有碳氧双键。与乙偶姻有关的反应如下:

(3)写出反应①、②的反应类型:反应① ___________、反应② ___________。
(4)A的一氯代物只有一种。写出A、乙偶姻、C的结构简式:
A ___________________、乙偶姻 __________________、C_________________。
(5)写出D → E反应的化学方程式_____________________________________。
(6)设计实验方案。
I.检验F中的官能团______________________________________。
II.完成反应③的转化___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得滤液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水中一定含有的离子是_________________________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是______________________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH-→ AlO2-+NH3+N2+H2O(未配平)。还原产物是_________,若除去0.2 mol NO3-,要消耗铝________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列装置不能达到有关实验目的的是( )
A.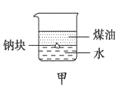 用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)
用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)
B.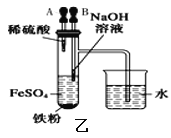 用乙图装置制备Fe(OH)2
用乙图装置制备Fe(OH)2
C.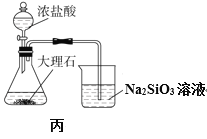 用丙图装置验证酸性:盐酸>碳酸>硅酸
用丙图装置验证酸性:盐酸>碳酸>硅酸
D.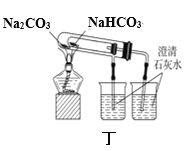 用丁图装置比较NaHCO3和Na2CO3的热稳定性
用丁图装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目: 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)经计算需要________mL浓盐酸。
(2)在配制稀盐酸溶液时,选用的仪器除了玻璃棒、烧杯、胶头滴管、还有______________。
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面最低处与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)___________________________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度________(填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度______(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是(__________)
A、纯铁硬度比生铁高
B、纯铁耐腐蚀性强,不易生锈
C、不锈钢是铁合金,只含金属元素
D、铁在一定条件下,可与水蒸气反应
E、铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为______,形成该分散系的微粒粒度范围是_______________。
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出 FeCl3溶液与铜反应的离子方程式_____________。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水,需要用到的一组试剂是____________。
A、①②④ B、①③④⑥
C、②④⑤ D、①④⑥
(4)高铁酸钠Na2FeO4 是一种新型净水剂,能够杀菌消毒。高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com