
科目: 来源: 题型:
【题目】第二代半导体材料——(Ⅲ-V)A族化合物的特殊性能使之成为科学家的研究热点之一。
(1) 基态镓原子的价电子轨道表示式为_____________。
(2) N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,N2O的空间构型为_________,NH4NO3中N的杂化方式为_________________,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)已知NH3分子的键角约为107°,而PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH¥的键角大的原因__________________________。
(4)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有________________。
(5)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因_____________________。
(6)磷化铝晶胞如图所示,A1原子的配位数为________,若两个铝原子之间的最近距离为d pm,NA代表阿伏加德罗常数的值, 则磷化铝晶体的密度ρ=_________g/cm3。

查看答案和解析>>
科目: 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
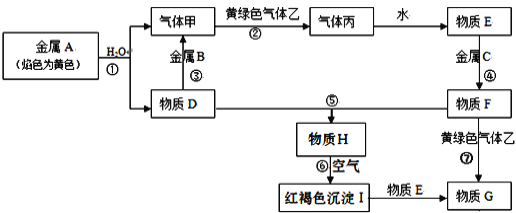
请回答下列问题:
(1)反应③的离子方程式___。
(2)反应⑥化学方程式____。
(3)反应⑦的离子方程式____;物质H在空气中的现象____。
(4)D溶液中加入B的氧化物固体的离子反应方程式为___,向反应后的溶液中通入过量CO2的离子反应方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如图装置(可重复选用)进行实验:
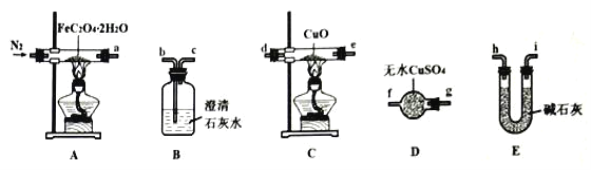
①装置D的名称为____。
②按照气流从左到右的方向,上述装置的连接顺序为____→尾气处理装置(填图中各仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为____。
④实验证明了气体产物中含有CO,依据的实验现象为_____。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。小组成员设计实验证明了其成分只有FeO,其实验操作及现象为:___。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为:___。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下(杂质不参与反应):
步骤1:称取2g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,向其中加入0.01mol·L1KMnO4溶液,恰好完全反应时消耗 KMnO4溶液30mL。
[已知:FeC2O4+KMnO4+H2SO4→Fe2(SO4)3+CO2↑+MnSO4+K2SO4+H2O(未配平)]
(4)草酸亚铁晶体样品的纯度为____;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A.C60和石墨
B.126C和136C
C.冰醋酸和乙酸
D.CH3CHO 与![]()
E.甲烷和十二烷
F.乙醇和乙二醇
①互为同系物的是_________________;
②互为同分异构体的是_____________;
③互为同位素的是________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要480mL1mol·L-1NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有___。
(2)如图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是___(填操作序号)。
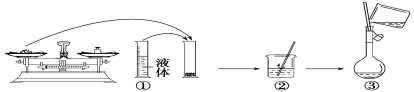
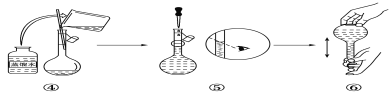
(3)下列操作会导致所配溶液的物质的量浓度偏高的是___。
A.配制NaOH溶液时,NaOH固体中含有Na2O杂质
B.用蒸馏水溶解NaOH固体后,立即转入容量瓶中定容
C.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
D.定容时仰视刻度线
E.用托盘天平称量 NaOH 固体时,砝码生锈
F.配制前容量瓶中有少量蒸馏水
(4)若某同学用密度为1.2g/cm3,质量分数为36.5%的浓盐酸配制100mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为___mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等。运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是__________(填元素符号),解释原因_____________________________________________
(2)二甲基二硫和甲酸中,在水中溶解度较大的是 (填名称),原因是_______;烧碱所属的晶体类型为______;硫化碱(Na2S)的S2-的基态电子排布式是____________。
(3)硝酸铵中,NO3-的立体构型为 ,中心原子的杂化轨道类型为__________
(4)1mol化合物NaCN中CN-所含的π键数为______,与CN-互为等电子体的分子有 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式___________。
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________;晶胞中K 原子的配位数为 ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 ________(列出计算式,不需要计算出结果)。

查看答案和解析>>
科目: 来源: 题型:
【题目】400K、101.3Kpa时,1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(相同条件下),若a=8时,该烃可能的分子式( )
A.CH4B.C2H6C.C3H8D.C4H8
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列十种物质:①HCl;②NaHCO3;③K2SO4溶液;④SiO2;⑤蔗糖晶体;⑥NaOH;⑦氢氧化铁胶体;⑧NH3·H2O;⑨空气;⑩Al2(SO4)3
(1)上述物质中属于电解质的有____(填序号),向⑦中逐滴滴入过量的①的水溶液,出现的实验现象是___。
(2)用④与⑥焙烧制备硅酸钠,可采用图中的装置为____(填选项编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式如图所示,关于该有机物的说法不正确的是
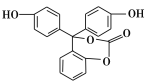
A.该有机物的化学式为C20H14O5
B.该有机物可发生加成、取代、氧化、消去等反应
C.该有机物分子中的三个苯环不可能共平面
D.1 mol该有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为5 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示。
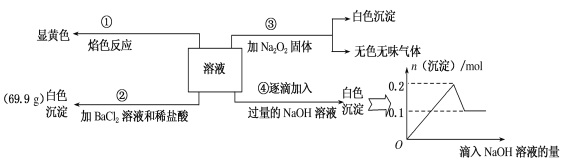
请回答下列问题:
(1)焰色反应是___(填“物理”或“化学”)变化;实验③中产生的无色无味气体是___(填化学式)。
(2)原溶液中一定存在的离子有___,一定不存在的离子有____。
(3)若溶液中K+物质的量为0.04mol,则c(Na+)=___mol/L。
(4)将一定量Fe2O3和Al2O3混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
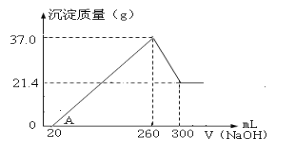
①混合物中含Fe2O3的质量为___g;
②所用硫酸溶液物质的量浓度为___mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com