
科目: 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
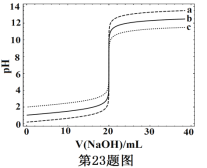
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目: 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)2NO2(g),在其他条件相同时,测得实验数据如表:
压强/(×105 Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据分析,下列说法正确的是
A.增大压强,反应速率变慢
B.升高温度,反应速率加快
C.在8.0×105 Pa、30℃条件下,当转化率为98%时反应已达平衡
D.若进入反应塔的混合气体为a mol,反应速率以v=Δn/Δt表示,则在8.0×105 Pa、30℃条件下,转化率从50%增至90%时段NO的反应速率为4a/370 mol·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
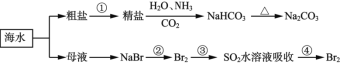
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)>V(氨水)
B.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐
C.Na2CO3溶液呈碱性的原因:CO32-+2H2OH2CO3+2OH-
D.0.1 molLˉ1CH3COOH溶液加水稀释,CH3COO- 数目增多,c(OH-)减少
查看答案和解析>>
科目: 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g) ![]() 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知:
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是
A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)
2N2(g)+3H2O(g) ![]() H<0。在恒容的密闭容器中,下列有关说法正确的是
H<0。在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
C.平衡时,其他条件不变,增加NH3的浓度,逆反应速率将减小
D.其他条件不变,使用高效催化剂,废气中氮氧化物的平衡转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】印刷铜制电路板的蚀刻液选取和回收再利用一直是研究的热点。
(1)FeCl3溶液一直作为传统的蚀刻液。
①蚀刻过程屮的离子方程式为______________________________。
②蚀刻结束后,可以通过两步先分离出铜,冉实现FcCl3溶液再生。
i.第1步所加试剂和操作分别为____________________________。
ii.第2步转化可加入的物质是_________________________(填一种即可)。
(2)H2O2也常用来做铜制电路板蚀刻液,使用时加入盐酸或氨水将其配制成酸性或碱性蚀刻液。应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:

①蚀刻铜板主要反应的离子方程式为_______________________。
②回收微米级Cu2O过程中,加入的试剂A是______(填字母)。
a.Fe粉 b.葡萄糖 C.NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程屮需控制反应的温度,当温度髙于80℃时,产品颜色发暗,其原因可能是______________________。
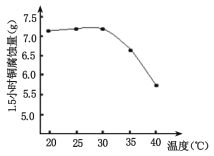
④如图是研究碱性蚀刻液的温度对锏腐蚀量的实验结果,升高温度,腐蚀量变化的原因______________________。
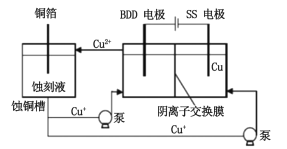
(3)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氡氧自由基(HO·),请写出BDD电极上的电极反应__________________,进一步溶液中反应可实现蚀刻液再生,请写出刻蚀液再生的离子方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】图中的原电池可以测定AgCl的沉淀溶解平衡常数。有关该原电池的说法不正确的是
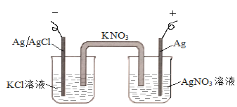
A.负极的电极反应式为:Ag+Cl--e-=AgCl
B.正极的电极反应式是Ag++ e-=Ag
C.电池总反应不是氧化还原反应,不能组成原电池
D.反应时,盐桥中的K+移向AgNO3溶液,NO3-移向KCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com