
科目: 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。如图是模拟工业制备氢溴酸粗品并精制流程:
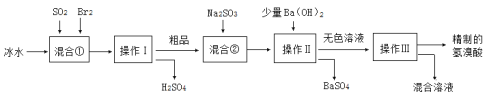
下列说法不正确的是
A.冰水的目的是降低反应温度,防止溴挥发,使反应更充分
B.混合①发生的反应为:SO2 +2H2O + Br2=H2SO4 + 2HBr
C.操作Ⅱ和操作Ⅲ的名称分别为过滤和蒸馏
D.Na2SO3的作用是调节溶液的pH也可以用Na2CO3替代
查看答案和解析>>
科目: 来源: 题型:
【题目】为了防止枪支生锈,常采用化学处理使枪支的钢铁零件表面生成Fe3O4的致密保护层— “发蓝”。化学处理过程中,其中一步反应为3Fe + NaNO2+5NaOH =3Na2FeO2+H2O+NH3↑。下列叙述不正确的是
A.该处理过程不会产生污染B.上述反应中铁被氧化
C.NO2-的氧化性大于FeO22-D.反应中转移2mole-,生成还原产物![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于离子检验的说法中正确的是
A.向某溶液中加入过量BaCl2溶液,产生白色沉淀,再加入过量稀盐酸,沉淀不溶解,则可推断该溶液中一定有SO42-
B.向某溶液中加入稀盐酸,若产生能使澄清石灰水变浑油的气体,则可推断该溶液中一定有CO32-
C.向某溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+
D.向某溶液巾先滴加氯水,再滴加KSCN溶液后显红色,则可推测该溶液中—定含有Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:

已知:R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)①的反应类型是_______________。 K中含有的官能团名称是_______________。
(2)E的名称是_______________。
(3)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是__________________。
(4)⑦的化学方程式是______________________________________________。
(5)⑥中还有可能生成分子式为C9H12O2产物。分子式为C9H12O2且符合下列条件的同分异构体共有__________ 种。写出其中两种核磁共振氢谱有5组峰的物质的结构简式_______________________________
a.属于芳香化合物 ,且苯环上只有两个取代基 b.1mol该物质能消耗1molNaOH
查看答案和解析>>
科目: 来源: 题型:
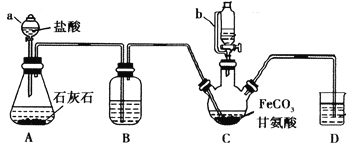
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L H2O中含有的原子数目为0.3NA
B.常温常压下,4.6 g NO2与N2O4混合气体中含有的氧原子数目为0.2 NA
C.0.1 molL-1 K2CO3溶液中含有的钾离子数目为0.2NA
D.0.lmol铁与足量氯气反应时,转移的电子数目为0.2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
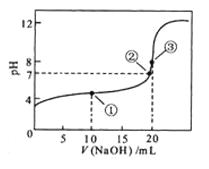
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
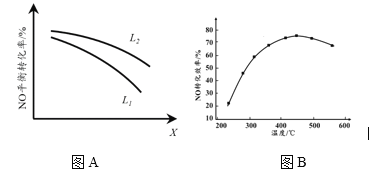
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A.小苏打用于治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O
B.铜与浓硝酸反应:Cu+3HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
C.用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=Cu2++2Fe2+
D.向漂白液中通入SO2提高漂白效率:ClO-+SO2+H2O=HClO+HSO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A.2 mol Na2O2与足量水发生反应转移4 mole-
B.少量的金属钠保存在煤油中
C.现代化学已经成为实验与理论并重的科学
D.高炉炼铁中实际起还原作用的是一氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com