
科目: 来源: 题型:
【题目】在TiCl3的饱溶液中通入HCl至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入HCl得到的是紫色晶体,已知两种晶体分子式均为TiCl3·6H2O,配位数都是6的配合物,分别取0.01mol两种晶体在水溶液中用过量AgNO3处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的![]() ,则下列有关说法不正确的是( )
,则下列有关说法不正确的是( )
A.该绿色晶体配体是氯离子和水,它们物质的量之比为1:5
B.紫色晶体配合物的化学式为[Ti(H2O)6]Cl3
C.上述两种晶体的分子式相同,但结构不同,所以性质不同
D.0.01mol紫色晶体在水溶液中与过量AgNO3作用最多可得到2.78g沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】合成某种滴眼液的原料为4-二甲氨基吡啶。下列叙述错误的是( )
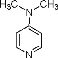
A.该分子中C原子的杂化类型有sp2、sp3
B.该分子中N原子的杂化类型有sp2、sp3
C.1mol该分子所含的σ键为15NA
D.该分子中含的大π键为Π![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A. 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O
B. 氢氧化亚铁暴露于空气中会变色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 向Ca(ClO)2溶液中通入过量CO2制取次氯酸: Ca2++ClO-+H2O+CO2=2HClO+CaCO3↓
D. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
查看答案和解析>>
科目: 来源: 题型:
【题目】甲同学利用下图所示装置进行硝酸、氮氧化物的相关实验:
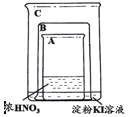
实验1:将铜片放入烧杯A后,立即用烧杯B盖住
(1)烧杯A液体上方出现大量红棕色气体,该反应的化学方程式为_________________
(2)一段时间后,红棕色气体消失,烧杯C中的液体变成蓝色,甲同学分析出现蓝色的原因,认为其中涉及到两个反应:
①红棕色气体消失,该化学方程式为_____________________________________________
②配平溶液出现蓝色的离子方程式,并用单线桥法标出电子转移方向和数目:
________I-+________![]() +________H+=________I2+________NO↑+________H2O
+________H+=________I2+________NO↑+________H2O
(3)打开烧杯B,A液体上方又出现淡棕色,该反应的化学方程式为__________________
实验Ⅱ:因为有其他同学对淀粉KI溶液变蓝的原因提出异议,甲同学将铜片换成铁片放入烧杯A后,立即用烧杯B盖住。
(4)实验前甲同学认为换为铁片后不应出现红棕色气体,淀粉KI溶液不会变为蓝色,其理由是____________________________________________________________________
(5)实验开始后,发现确实无红棕色气体生成,但过一段时间后,淀粉KI溶液仍然变为蓝色,请你帮忙分析其中的原因_________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述及相关解释均正确的是( )
选项 | 叙述 | 解释 |
A | 键的极性的强弱:N-H>O-H>F-H | 电负性:N<O<F |
B | 石墨的熔点高于金刚石 | 碳碳键的键长:石墨<金刚石 |
C | 熔点: | Ⅰ形成分子内氢键,Ⅱ形成分子间氢键 |
D | 酸性:HI>HBr>HCl | HI、HBr、HCl中的范德华力逐渐减小 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】以废铁屑(含有少量镍)制备高铁酸钾(K2FeO4)的流程如下图所示:
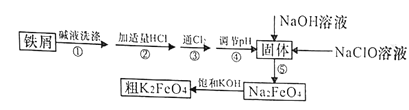
已知:25℃时,一些金属氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
M(OH)m | PH | |
开始沉淀 | 沉淀完全 | |
Fe (OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)K2FeO4中铁元素的化合价为________________。
(2)“碱液洗涤”的目的是除去铁屑表面的油污,实际一般选用Na2CO3溶液除污,选用Na2CO3溶液除污的原理是____________________________(用离子方程式表示)。
(3)步骤③发生反应的离子方程式为___________________。
(4)步骤⑤是将Fe(OH)3固体氧化为Na2FeO4,同时NaClO转化为NaCl。则生成1mol Na2FeO4消耗NaClO的质量为______g;步骤④调节pH的范围是_______。
(5)用滴定法测定所制粗K2FeO4的纯度(杂质与KI不反应):取0.220g粗K2FeO4样品,加入足量硫酸酸化的KI溶液,充分反应后,用0.200mol·L-1Na2S2O3标准溶液滴定生成的I2,滴定消耗标准溶液的体积为20.00mL。涉及的反应有:FeO42-+4I-+8H+=Fe2++2I2+4H2O,2S2O32-+I2=S4O62-+2I-。
①滴定时选用的指示剂为______,滴定终点的现象为_____________。
②粗K2FeO4的纯度为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】第ⅤA族元素的原子R与Cl原子结合形成的RCl5分子在气态和液态时,分子结构如图所示,下列有关于RCl5分子的说法中不正确的是( )
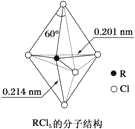
A.分子中5个R-Cl键的键能不都相同
B.键角(Cl-R-Cl)有90°、120°、180°几种
C.每个原子都达到8电子稳定结构
D.RCl5受热分解生成的RCl3分子的立体结构呈三角锥形
查看答案和解析>>
科目: 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,请回答下列问题:
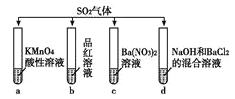
(1)试管a出现溶液褪色的现象,说明SO2具有________性;试管b出现溶液褪色的现象,说明SO2具有________性。
(2)试管d出现白色沉淀,该沉淀能够溶解在稀盐酸中,写出生成该沉淀的离子方程式:________________。
(3)如果将试管d中的NaOH更换为Br2和BaCl2的混合溶液,可以得到一种难溶于强酸的白色沉淀;写出该过程中发生氧化还原反应的离子方程式:________。
(4)试管c中也可得到难溶于强酸的白色沉淀,请你简述该沉淀的生成原因:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌是人体必需的微量元素,在体内有着重要的功能,然而过度的Zn2+会引起毒性,因此能够高效、灵敏检测Zn2+的方法非常重要。化合物L对Zn2+有高识别能力和良好的抗干扰性,其合成路线可设计如下:
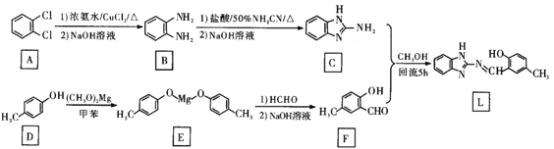
回答下列问题:
(1)A的化学名称为____________F的官能团名称为____________。
(2)D生成E的化学方程式为________________,该反应类型为____________。
(3)已知R-N=N-R分子中的N原子存在孤对电子(未共用电子对),且N = N双键不能旋转,因而存在顺反异构:![]() (顺式),
(顺式),![]() (反式)。判断化合物L是否存在顺反异构________(填“是”或“否”)。
(反式)。判断化合物L是否存在顺反异构________(填“是”或“否”)。
(4)研究人员利用某种仪器进行分析,发现化合物L中亚氨基(-NH-)及-OH上的氢原子的.吸收峰在结合Zn2+后的谱图中消失,该仪器的名称是___________仪;研究人员推测化合物L结合Zn2+的机理为:![]() 其中,Zn2+与-N=之间共价键的成键方式是________(填标号)。
其中,Zn2+与-N=之间共价键的成键方式是________(填标号)。
a. Zn2+和N原子各自提供单电子组成共用电子对
b. Zn2+单方面提供电子对与N原子共用
c. N原子单方面提供电子对与Zn2+共用
(5)X为F的芳香族同分异构体,写出满足如下条件的X的结构简式_____________。
①能发生水解反应和银镜反应,产物之一能与FeCl3溶液发生显色反应;
②有六种不同化学环境的氢,个数比为3:1:1:1:1:1。
(6)已知:通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。化合物Y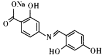 具有抑菌活性,以
具有抑菌活性,以![]() 和
和![]() 为原料制备Y,写出合成路线(有机溶剂和无机试剂任选)。____________。
为原料制备Y,写出合成路线(有机溶剂和无机试剂任选)。____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】N4分子结构如图所示,已知断裂1molN-N键吸收167kJ热量,生成1molN≡N放出945kJ热量。根据以上信息和数据,下列说法正确的是( )
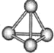
A.N4属于由非极性键构成的极性分子
B.氮元素非金属性比磷强,可知N4沸点比P4(白磷)高
C.1molN4气体转变为N2气体放出888kJ热量
D.N4和N2互为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com