
科目: 来源: 题型:
【题目】下图是依据各种元素(原子)的性质与原子序数(1~20)的关系而绘制出来的,各图的纵轴可能代表下列某一性质:核电荷数,中子数、最高正化合价、原子半径、得电子能力,A、B、C分别代表三种元素.(注意:图3中原子序数为8、9的元素和图4中原子序数为2、10、18的元素在纵轴上没有对应的数值.)
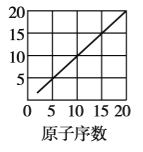
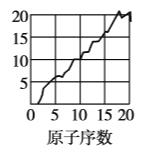
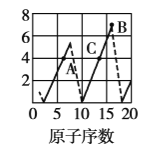
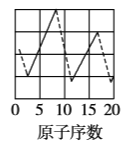
请回答下列问题:
(1)图2的纵轴代表的性质是______,图4的纵轴代表的性质是______.
(2)A元素的最低负化合价为______.
(3)B、C两种元素形成的化合物中,C显最高正化合价而B显最低负化合价,该化合物的化学式为______.
(4)1~20号元素中,原子(稀有气体元素原子除外)半径最大的是__(填元素符号)
(5)写出B的单质与NaOH溶液反应的离子方程式:____________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】V2O5可作化学工业中的催化剂,广泛用于冶金、化工等行业。V2O5是一种橙黄色片状晶体,微溶于水,具有强氧化性,属于两性氧化物。某研究小组将从钒铅锌矿(主要含有V2O5、PbO、ZnO、CaO)中提取V2O5及回收铅、锌等金属。工艺流程如下图所示:
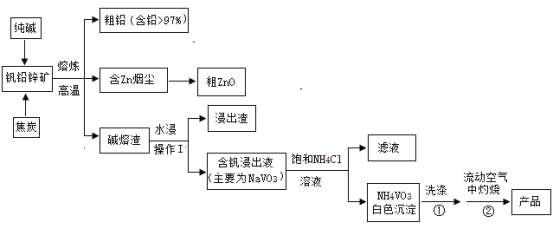
已知:NH4VO3是白色粉末,可溶于热水,微溶于冷水,不溶于乙醇、乙醚。2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
请回答:
(1)钒铅锌矿高温熔炼时,生成金属铅的反应属于基本反应类型中的________反应; V2O5与纯碱反应的化学方程式为_______________________。
(2)流程中操作I的名称是_______________________。
(3)焦炭用量对还原熔炼效果的影响如下左图所示。分析图像可知,焦炭用量应取矿石质量的约______% 较为合适。

(4)钒浸出过程中,液固比(液体质量:固体质量)对钒浸出率的影响如上右图所示。分析图像可知,浸出过程的液固比最合适的比例约为2:1,理由是___________。
(5)为制取纯度较高的V2O5,往含钒浸出液(主要为NaVO3)中加NH4Cl溶液,该反应的化学方程式是_________________________。
(6)在洗涤①操作时,可选用的洗涤剂________ (填选项字母)。
A.乙醚 B.1% NH4Cl 溶液 C.热水 D.冷水
(7)在灼烧②操作时,需在流动空气中灼烧的可能原因_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】橙花叔醇是一种具有香气的有机化合物,可用于配制玫瑰型、紫丁香型等香精,其结构如图所示,下列相关说法正确的是

A. 橙花叔醇的分子式为C15H24O
B. 橙花叔醇能发生氧化、还原、取代、聚合等类型的反应
C. 橙花叔醇与钠和NaOH均能发生反应
D. 橙花叔醇的同分异构体中可能含有苯环
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制取冰晶石(![]() )的化学方程式为
)的化学方程式为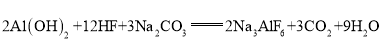 ,反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是( )
,反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是( )
A.简单氢化物的稳定性强弱
B.最高价氧化物对应水化物的碱性或酸性强弱
C.原子达到稳定结构失去或得到电子的多少
D.元素的最高化合价的高低
查看答案和解析>>
科目: 来源: 题型:
【题目】钴(Co)及其化合物在工业上广泛应用于磁性材料、电池材料及超硬材料等领域。某学习小组欲从某工业废料中回收钴,设计工艺流程如下:(废料中含有Al、Co2O3 和Fe2O3等物质)。
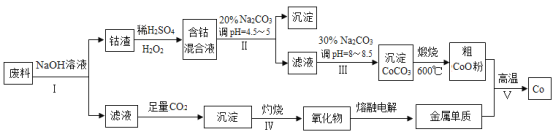
请回答:
(1)废料用NaOH溶液处理前通常先将废料粉碎,其目的是____________。
(2)过程Ⅱ用稀H2SO4和H2O2溶液与Co2O3反应而达到浸出钴的目的,请写出该反应的离子方程式___________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________。
(3)碳酸钠溶液在过程Ⅱ和Ⅲ中所起作用有所不同,请写出碳酸钠在过程Ⅱ中发生反应生成沉淀的离子方程式__________________________________。
(4) 若在实验室中完成过程Ⅳ,则沉淀物需在__________________(填仪器名称)中灼烧;写出在过程Ⅴ中发生反应的化学方程式__________________________________。
(5)将1.0×10-3 mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________ mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
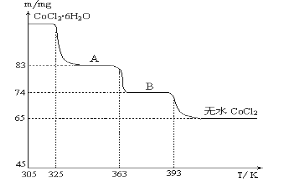
(6)CoO与盐酸反应可得粉红色的CoCl2溶液。CoCl2晶体因结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体在烘箱中受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上综合利用铝土矿的部分工艺流程如下。
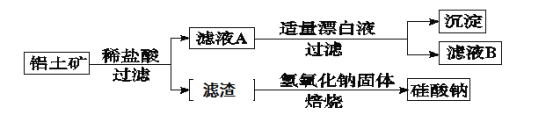
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ = □Fe(OH)3↓+□C1-+ 。
(2)检验滤液B中是否还含有Fe2+的方法为: 。
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(5)滤渣的主要成分是 (填化学式),其与NaOH固体焙烧制备硅酸钠,可采用的装置为 (填代号),该反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】部分短周期元素原子半径与原子序数的关系如图所示.则下列说法正确的是( )
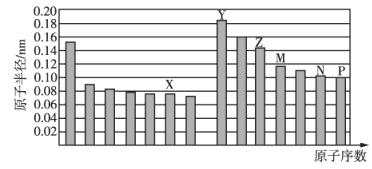
A.简单离子半径:![]()
B.简单氢化物的稳定性:![]()
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物既能溶解于Y的最高价氧化物对应水化物的水溶液中,也能溶解于P的氢化物的水溶液中
查看答案和解析>>
科目: 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用。其工作流程如下图所示:
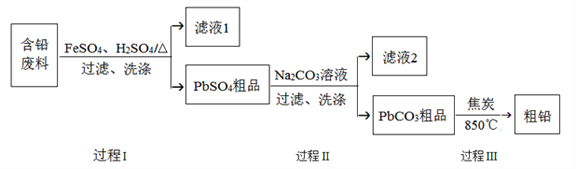
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42-![]() 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.___________。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42-)=1.6mol/L,c(CO32-)=0.1mol/L,则PbCO3中____(填“是”或“否”)混有PbSO4。
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发 生反应:PbSO4+3OH-=HPbO2-+SO42-+H2O。
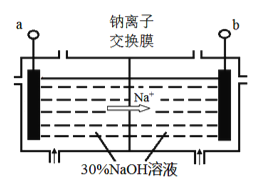
①a与外接电源的________极相连。
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为___________。
③与传统无膜固相电解法相比,使用钠离子交换膜可以 提高Pb元素的利用率,原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2 等杂质]为原料,制备金属钛和铁红的工艺流程如下:已知:①酸溶时,FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]= 1.0×10-11;请回答下列问题:
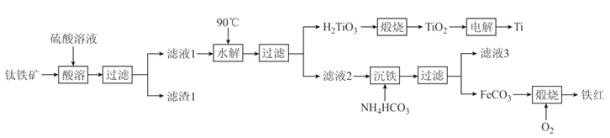
(1)FeTiO3中Ti元素的化合价为_______价。铁红的用途为________________(任写一种)。
(2)“水解”中,发生反应的离子方程式为____________________________________________。
(3)“沉铁”中,气态产物的电子式为_________;该过程需控制反应温度低于35℃,原因为_____________。
(4)FeCO3转化为铁红时,发生反应的化学方程式为________________________________________。
(5)滤液3可用于制备Mg(OH)2。若滤液3 中c(Mg2+)=1.2×10-4 mol·L-1,向其中加入等浓度等体积的NaOH溶液时,通过计算说明有无沉淀生成______________________________(溶液体积近似叠加)。
(6)电解生产钛时用TiO2和石墨做电极,电解质为熔融的CaO,则阴极反应式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2d.CO2
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:__________
(3)工业生产甲醇的常用方法是:CO(g)+2H2(g)![]() CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H =________。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
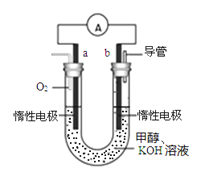
①该电池工作时,负极是_______极(填“a”或 “b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为_________________。
(5)电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s)+4HCl(aq)![]() 2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
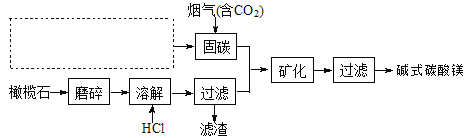
①某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为_____________。
②在上图虚框内补充一步工业生产流程______________。
③经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com