
科目: 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.NaHCO3溶液:K+、SO42-、Cl-、AlO2-
B.由水电离出的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.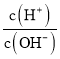 =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
①符合通式CnH2n+2 的烃一定都是烷烃,分子中均只含单键
②苯能使溴水褪色,说明苯环结构中含有碳碳双键
③乙酸与油酸一定不是同系物
④乙烯能使溴水和酸性KMnO4 溶液褪色,且反应类型相同
⑤![]() 与
与![]() 是同分异构体
是同分异构体
⑥相同质量的烃完全燃烧,耗氧量最大的是 CH4
⑦戊二酸的分子式是C5H8O4,符合此分子式的二元酸有 3 种
A.①③⑦B.①③⑥C.②⑥⑦D.④⑤⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】锂盐二氟草酸硼酸锂[LiBF2(C2O4)]是新型锂离子电池电解质,乙酸锰可用于制造离子电池的负极材料。合成方法如下:
2H2C2O4+SiCl4+2LiBF4=2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)26H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为_____。
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是_______,1mol草酸分子中含有σ键的数目为______。
(3)与SiF4互为等电子体的阴离子的化学式为______。
(4)CH3COOH易溶于水,除了它是极性分子外,还因为_______。
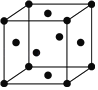
(5)锰的一种晶胞结构如图所示,锰晶体中每个锰原子距离最近的锰原子数目为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH356. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将_________(填“偏高”、或“偏低”或“不变”)。
(2)氨气常用__________________检验,现象是________________。
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。________
查看答案和解析>>
科目: 来源: 题型:
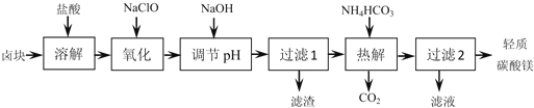
【题目】轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁的工艺流程如图:
下表中为生成氢氧化物沉淀的pH
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 9.9 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
(1)“氧化”一步中发生反应的离子方程式为______。
(2)“调节pH”一步应调节溶液的pH=9.8,其目的是_______。
(3)“热解”一步温度控制在75℃左右,其原因是_____。
(4)从“过滤2”步骤中得到的滤液中能回收的盐类物质主要有______(填化学式)。
(5)轻质碳酸镁的成分为碱式碳酸镁[MgCO3Mg(OH)23H2O],则“热解”一步发生反应的离子方程式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液中存在电离平衡、水解平衡、沉淀溶解平衡等多种形式的化学平衡。
(1)常温下,用0.10molL-1NaOH溶液滴定20.00mL0.10molL-1CH3COOH溶液,滴定曲线如图所示。
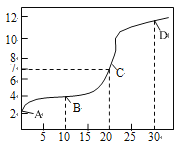
①B点所示的溶液中:c(Na+)+c(H+)_____c(CH3COOH)+c(OH-)(填“>”、“=”或“<“)。
②C点为理论上的反应终点,则该滴定实验应选用的指示剂是____,此时溶液的pH大于7,原因是____(用化学用语表示)。
③点D所示溶液中c(H+)、c(OH-)、c(CH3COOH)、c(CH3COO-)四者之间的等量关系式为:c(OH-)-c(H+)=______。
(2)已知常温时Ksp[Al(OH)3]=1×10-33,Ksp[Mg(OH)2]=5.6×10-12,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.9×10-5。
①常温下,某溶液中c(Mg2+)=5.6mol/L,欲除去该溶液中的Al3+(使其浓度小于1×10-5mol/L),需要调节pH的范围为______<pH<_____。
②常温下,CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)平衡常数的值为_______。
CaCO3(s)+SO42-(aq)平衡常数的值为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)一定温度下,向1L0.1molL-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向_____(填“正”或“逆”)反应方向移动;溶液中![]() 的值_____ (填“增大”、“减小”或“不变”)。
的值_____ (填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3H2O,已知:
a.常温下,CH3COOH和NH3H2O的电离平衡常数均为1.74×10-5;b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈______性(填“酸”、“碱”或“中”),NH4HCO3溶液呈______性;NH4HCO3溶液中物质的量浓度最大的离子是_____。
(3)99℃时,Kw=1.0×10-12,该温度下测得0.1molL-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______。
②该温度下,将0.01molL-1H2A溶液稀释到20倍后,溶液的pH=______。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气______。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1molL-1H2A溶液与0.2molL-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为______。
(4)人们配制氯化铁溶液时,常将氯化铁晶体先溶于_____,然后再加水稀释,通过增加溶液中______离子的浓度,来抑制铁离子的水解,当实验室制备氢氧化铁胶体时,常采用的方法是向_______中滴加数滴氯化铁溶液,并持续加热至沸腾,以促进铁离子的水解。
(5)欲除去硫酸铜溶液中混有的少量铁离子和亚铁离子,可向溶液中加入少量稀硫酸和_____,再向溶液中加入_______和_____,调节溶液的pH至3~4,使含铁杂质离子转化为氢氧化铁沉淀而除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com