
科目: 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在。
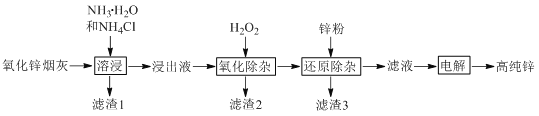
回答下列问题:
(1)Zn(NH3)42+中Zn的化合价为________,“溶浸”中ZnO发生反应的离子方程式为________。
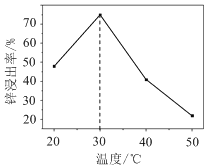
(2)锌浸出率与温度的关系如图所示,分析30 ℃时锌浸出率最高的原因为________。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为________。
(4)“滤渣3”的主要成分为________。
(5)“电解”时Zn(NH3)42+在阴极放电的电极反应式为_______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是________(写化学式)。电解后的电解液经补充________(写一种物质的化学式)后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中肯定错误的是( )
A. 某原子K层上只有一个电子
B. 某原子M层上电子数为L层上电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 某离子的核电荷数与最外层电子数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】某香料(H)的一种合成路线如下:
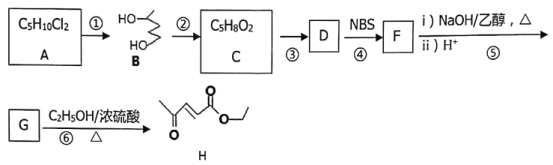
已知:![]()
回答下列问题:
(1)A的系统命名为_____,反应⑤第i)步反应化学方程式为________。
(2)反应②的试剂与条件为:_________,反应①→⑥中属于取代反应的有(填反应编号)____。
(3)D的结构简式为:________。
(4)写出符合下列要求的G的同分异构体结构简式:______。
①具有六元环状结构,不含其他环状结构
②核磁共振氢谱显示只有二种信号峰且二信号峰面积之比为1:2
③不能使溴的四氯化碳溶液褪色
(5)参照上述合成路线,设计以2-甲基丁酸和苯甲醇为原料合成![]() _______。
_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】G是一种治疗急慢性呼吸道感染的特效药中间体,其制备路线如图:

(1)化合物C中的含氧官能团是_____。
(2)A→B的反应类型是______。
(3)化合物F的分子式为C14H21NO3,写出F的结构简式______。
(4)从整个制备路线可知,反应B→C的目的是______。
(5)同时满足下列条件的B的同分异构体共有_______种。
①分子中含有苯环,能与NaHCO3溶液反应;
②能使FeCl3溶液显紫色
(6)根据已有知识并结合相关信息,完成以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线图____(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线图____(无机试剂任用,合成路线流程图示例见本题题干)。
 ,其中第二步反应的方程式为_____。
,其中第二步反应的方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是_______(用对应的元素符号表示);基态D原子的电子排布式为______。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取_____杂化;BC3-的立体构型为______(用文字描述)。
(3)1mol AB-中含有的π键个数为______。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比______。
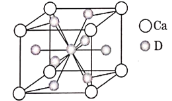
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。己知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________(保留2位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。碳是地球上组成生命的最基本的 元素之一。按要求回答:
(1)宇宙中含量最多的元素是氢和______。基态碳原子的核外电子占有______个原子轨道。
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN 中 C 的杂化方式有______。1mol PAN 中含有的σ键数目为______。组成PAN 的元素的电负性大小顺序为______。
②相同压强下,HCOOH 的沸点比 CH3OCH3______(填“高”或“低”),
(3)水溶液中有 H3O+、H5O2+ 、H9O4 + 等微粒的形式。请画出 H5O2 的结构式:______。
(4)硅和碳在同一主族。下图为 SiO2 晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是______nm。
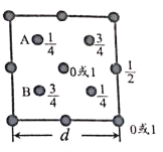 (d 的单位为 nm)
(d 的单位为 nm)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】用 VSEPR 模型预测下列分子或离子的立体结构,其中正确的是( )
A.NH4+为正四面体形B.CS2为 V 形
C.HCN 为 V 形D.PCl3 为平面三角形
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学探究小组拟用铜片制取Cu(NO3) 2,并探究其化学性质。
I.他们先把铜粉放在空气中灼烧,再与稀HNO3反应制取硝酸铜。
(1)如果直接用铜屑与稀HNO3反应来制取硝酸铜,可能导致的两个不利因素是______。
(2)实验中铜粉应该放在_____(选填“蒸发皿”、“坩埚”或“烧杯”)中灼烧。欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序分别是___、____、过滤。
II.为了探究Cu(NO3)2的热稳定性,探究小组按下图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)
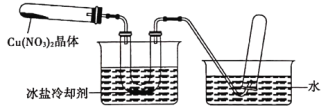
往左试管中放入研细的无水Cu(NO3)2晶体并加热,观察到左试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在右试管中收集到无色气体。
(1)红棕色气体是____。
(2)当导管口不再有气泡冒出时,停止反应,这时在操作上应注意________。
(3)探究小组判断Cu(NO3)2的分解属于氧化还原反应,产物除了红棕色气休和黑色固体外,进一步分析、推断,分解产物中一定还含有_____。
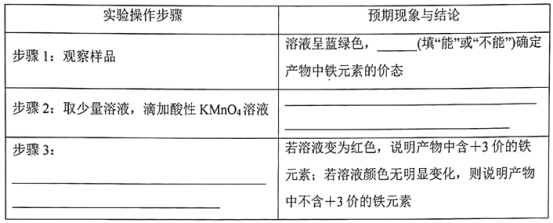
III.为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请在下面表格中补充写出实验操作步骤、预期现象与结论___、___、___。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(一)①己知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol,CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8 kJ/mol,
2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ/mol,
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的△H=_____。
2CO(g)+2H2(g)的△H=_____。
②250℃时,以镍合金为催化剂,向2L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=______。2min内CO2平均消耗速率为________。
2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=______。2min内CO2平均消耗速率为________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300℃时,乙酸的生成速率减小的原因是_________。
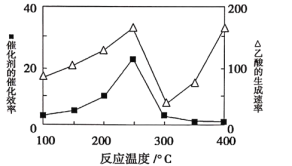
②为了提高该反应中CH4的转化率,可能采取的措施是__________________。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为_____________________。
(3)第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供动力,降低油耗;在刹车或下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH溶液)为电解质溶液。镍氢电池充放电原理示意图如下,其总反应式为H2+2NiOOH![]() Ni(OH)2。
Ni(OH)2。
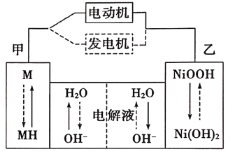
根据所给信息判断,混合动力车上坡或加速时,该电池处于________(选填“充电”或“放电”),乙电极的电极反应式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com