
科目: 来源: 题型:
【题目】已知断开1 mol Cl2(g)中Cl-Cl键需要吸收243 kJ能量。根据能量变化示意图,下列说法或热化学方程式正确的是

A.H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol-1
B.生成1 mol H2(g)中的H-H键放出121.5 kJ能量
C.断开1 mol HCl(g)中的H-Cl键要吸收864 kJ能量
D.HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g) △H=-92.5 kJ·mol-1
Cl2(g) △H=-92.5 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】铜能与浓硫酸在加热条件下反应,反应方程式为:
_____Cu +____H2SO4(浓) ![]() _____CuSO4 +____SO2↑+_____H2O
_____CuSO4 +____SO2↑+_____H2O
(1)配平上述方程式,并用双线桥法分析电子转移的方向和数目___________(在答题卷上的方程式中表示);
(2)该反应中还原剂为___________,氧化产物为__________;
(3)该反应中浓H2SO4体现____________性;
(4)还原剂与氧化剂的物质的量之比为______,标况下若生成SO2的体积为11.2 L,则反应时转移的电子为_______ mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe2+、Al3+、NH4+、Cl、CO32 和SO42。现每次取100.00mL进行实验:(已知:NH4++OH - ![]() NH3↑ +H2O)
NH3↑ +H2O)
① 第一份加入AgNO3溶液有沉淀产生;
② 第二份加入足量NaOH后加热,收集到气体0.896 L(标准状况下)
③ 第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。请回答:
(1)c(CO32) =_________mol/L;
(2)K+ 是否存在?__________;若存在,浓度范围是__________(若不存在,则不必回答第2问);
(3)根据以上实验,不能判断______(填离子符号)是否存在。若存在此离子,如何进行检验?_____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )

A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下的反应为SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,此温度下,该反应的平衡常数为
SO3(g) △H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,此温度下,该反应的平衡常数为
A.1B.3C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,根据数据计算该浓盐酸中HCl的物质的量浓度为____________。

(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______.
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______mL上述浓盐酸进行配制,确定溶液体积的容器是________(填名称)。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
a.实验前,容量瓶中有少量蒸馏水.___________。
b.用量筒量取浓盐酸时俯视观察凹液面.__________。
c.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水.__________。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取______mL盐酸.
②假设该同学用新配制的盐酸中和含0.4gNaOH的溶液,发现比①中所求体积偏小,则可能的原因是________________。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目: 来源: 题型:
【题目】减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式___。
(2)以甲醇做燃料的电池,如图所示,其负极是___(填a或b),负极的反应式为___,正极的反应式为___。该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为___。

查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:
CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H1=﹣443.64kJmol﹣1
2CO(g)+O2(g)=2CO2(g) △H2=﹣566.0kJmol﹣1
下列说法或热化学方程式正确的是( )
A.CO的燃烧热为566.0kJmol﹣1
B.2molCO和1molO2的总能量比2molCO2的总能量低
C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3kJ
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1453.28kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验是化学研究的基础,关于下列各实验装置图的叙述正确的是( )
|
|
|
|
① | ② | ③ | ④ |
A.装置①中溶液上层无色,下层紫红色B.装置②可用于吸收HCl气体,并防止倒吸
C.装置③可用于制取蒸馏水D.装置④中液体蒸干后停止加热
查看答案和解析>>
科目: 来源: 题型:
【题目】一种甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图:
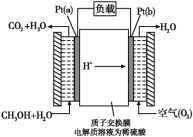
请回答下列问题:
(1)Pt(a)电极反应为________;如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有________mol。
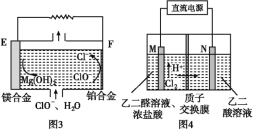
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式________。
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛(OHC—CHO)与M电极的产物反应生成乙醛酸。
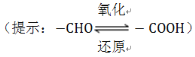
①N电极上的电极反应式为________。
②若2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com