
科目: 来源: 题型:
【题目】在体积可变的密闭容器中发生可逆反应:2NO2(g)![]() 2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
A.单位时间内生成n mol O2的同时生成n mol NO2
B.NO2、NO、O2三者的物质的量浓度之比为2:2:1
C.混合气体的密度不再改变
D.容器中气体压强不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
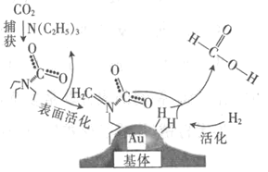
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X(g)和Y(g)可以相互转化:2X(g)![]() Y(g) ΔH<0。现将一定量X(g)和Y(g)的混合气体通入一体积为1 L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是
Y(g) ΔH<0。现将一定量X(g)和Y(g)的混合气体通入一体积为1 L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是
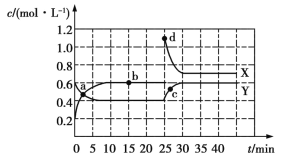
A.若混合气体的压强不变,则说明反应已达化学平衡状态
B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点
C.25~30 min内用X表示的平均化学反应速率是0.08 mol·L-1·min-1
D.反应进行至25 min时,曲线发生变化的原因是增加Y的浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应2X(g)+3Y(g)![]() 4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是
4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是
A.c1∶c2=2∶3
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为3∶4
D.c1的取值范围为0<c1<0.28 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知
是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知![]() 的一种核素的质量数为18,中子数为10;
的一种核素的质量数为18,中子数为10;![]() 是短周期元素中原子半径最大的元素(不考虑稀有气体元素的原子半径);
是短周期元素中原子半径最大的元素(不考虑稀有气体元素的原子半径);![]() 的单质呈黄色,常见于火山口附近。下列说法正确的是
的单质呈黄色,常见于火山口附近。下列说法正确的是
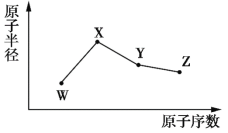
A.![]() 的最高价氧化物对应水化物的酸性强于
的最高价氧化物对应水化物的酸性强于![]()
B.简单离子半径:![]()
C.![]() 的简单氢化物的沸点高于同族其他元素的简单氢化物
的简单氢化物的沸点高于同族其他元素的简单氢化物
D.将标准状况下等体积的![]() 的单质与
的单质与![]() 的低价氧化物同时通入品红溶液中,品红溶液迅速褪色
的低价氧化物同时通入品红溶液中,品红溶液迅速褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种短周期非金属元素的原子半径与原子序数有如图所示的关系,化合物
五种短周期非金属元素的原子半径与原子序数有如图所示的关系,化合物![]() 是水煤气的主要成分之一,下列说法不正确的是
是水煤气的主要成分之一,下列说法不正确的是
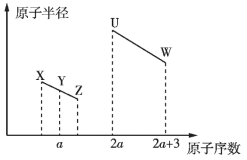
A.![]() 与氢氧化钠溶液反应可能生成酸式盐
与氢氧化钠溶液反应可能生成酸式盐
B.![]() 与
与![]() 形成的化合物中含有离子键
形成的化合物中含有离子键
C.![]() 、
、![]() 、
、![]() 元素的最高价氧化物对应水化物的酸性依次增强
元素的最高价氧化物对应水化物的酸性依次增强
D.若元素![]() 的原子序数大于
的原子序数大于![]() 且与
且与![]() 同主族,则
同主族,则![]() 的金属性强于
的金属性强于![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】体积不变的容器中发生2HI(g)H2(g)+I2(g),下列叙述中可以说明反应2HI(g)H2(g)+I2(g)已达到平衡状态的是( )
①单位时间内生成nmolH2的同时生成nmolHI
②反应体系的颜色不再变化
③百分组成w(HI)=w(I2)
④反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
⑤c(HI):c(H2):c(I2)=2:1:1
⑥v分解(HI)=v生成(HI)
⑦压强不变
A.①③⑤B.②⑥C.④⑤D.④⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】放热反应CO(g)+H2O(g)CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A.K2和K1的单位均为mol·L-1B.K2<K1
C.c2(CO)>c2(H2O)D.c1(CO)>c2(CO)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
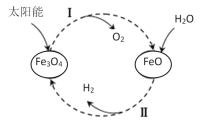
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com