
科目: 来源: 题型:
【题目】下列有关叙述正确的是
A.某温度下,1 L pH = 6 的纯水中含 OH一为10-8mol
B.25℃ 时,向0. 1 mo lL-1 CH3COONa 溶液中加入少量水,溶液中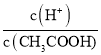 减小
减小
C.25℃时,将 V1 L pH = 11的 NaOH溶液与V2 L pH = 3 的H A 溶液混合,溶液显中性,则V1 ≤V2
D.25℃时,将 a molL-1 氨水与0.01 molL- 1 盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示 NH3H2O)的电离常数 Kb = ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500g。
步骤Ⅱ 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数___(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积___(填“偏大”、“偏小”或“无影响”)。
对滴定结果的分析最终都是由___的变化来分析C测变化。
③滴定时边滴边摇动锥形瓶,眼睛应观察___。
④滴定达到终点现象__ 。
(2)滴定结果如下表所示:
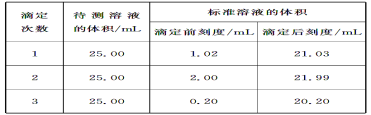
若NaOH标准溶液的浓度为0.1010mol/L,则该样品中氮的质量分数为___。(保留4位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下所示。下列说法错误的是

A.甲位于现行元素周期表第四周期第ⅢA族
B.原子半径比较:甲>乙>Si
C.原子序数:甲-Ca=1
D.推测乙的单质可以用作半导体材料
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数值,下列说法正确的是( )
A.46gNO2和N2O4混合气体中含有原子数为3.5NA
B.50g质量分数为46%的乙醇水溶液中氧原子数为2NA
C.用惰性电极电解H2SO4溶液,若阳极产生5.6L气体,则电路中通过0.5NA电子
D.常温下,1LpH=3的醋酸溶液稀释到10L时,溶液中H+的数目大于0.01NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关仪器的名称、图形、用途与使用操作的叙述均正确的是( )
选项 | A | B | C | D |
名称 | 250 mL容量瓶 | 分液漏斗 | 酸式滴定管 | 冷凝管 |
图形 |
|
|
|
|
用途与使用操作 | 配制1.0 mol·L-1NaCl溶液,定容时俯视刻度,则配得的溶液浓度小于1.0 mol·L-1 | 用甘油萃取碘水中的碘,分液时,碘层需从上口放出 | 可用于量取10.00mL 新制氯水溶液 | 蒸馏实验中将蒸气冷凝为液体 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】农药波尔多液的主要成分是CuSO4,下列两个反应都有CuSO4生成。
①Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
②CuO+H2SO4=CuSO4+H2O
反应①的副产物SO2是大气污染物,可用NaOH溶液吸收,发生反应的化学方程式为( )
A.NaOH+SO2=Na2SO3
B.NaOH+SO2=Na2SO3+H2O
C.2NaOH+SO2=Na2SO3+H2O
D.2NaOH+SO2=2NaHSO3+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两种有机物的球棍模型如下,下列有关二者的描述中正确的是( )
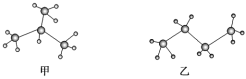
A.甲、乙为同一物质
B.甲、乙互为同分异构体
C.甲、乙一氯取代物的数目不同
D.甲、乙分子中含有的共价键数目不同
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是

A.CO、SO2、SO3均是酸性氧化物
B.工业上利用Cl2和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物的转化对工农业生产及环境保护有重要的意义。
(1)下面是氮的氧化物在几种不同情况下的转化:
①已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0kJ·mol-1
2NO2(g) ΔH=-113.0kJ·mol-1
则SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为___。
②a.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使其反应达到平衡,正反应速率随时间变化的示意图如图1所示。反应在c点___(填“达到”或“未到”)平衡状态。
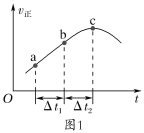
b.开始时,分别在该容器中加入Ⅰ:2molSO2(g)和2molNO2(g);Ⅱ:2molSO3(g)和2molNO(g)。则反应达到平衡时,平衡常数:Ⅰ__(填“>”“=”或“<”)Ⅱ。
(2)常温时向浓度为0.1mol·L-1体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸体积的变化曲线如图2所示,d点处两种溶液恰好完全反应。根据图2回答下列问题:
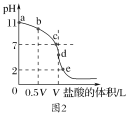
①b、c、d三点对应的溶液中,水电离的c(OH-)由大到小的顺序为____。
②滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有___。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
③该温度时氨水的电离平衡常数K=___。
(3)氮的氧化物易污染环境,可用氢氧化钠溶液吸收。发生的反应为:
2NaOH+NO+NO2=2NaNO2+H2O
2NaOH+2NO2=NaNO3+NaNO2+H2O
将反应混合液和氢氧化钠溶液分别加到如图3所示的电解槽中进行电解,A室产生N2。
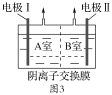
①电极Ⅱ是__极,B室产生的气体是___。
②A室NO2-发生的电极反应是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com