
科目: 来源: 题型:
【题目】依据氧化还原反应:2Ag++Cu=Cu2++2Ag,设计的原电池如图所示。
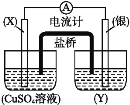
请回答下列问题:
(1)电极X的材料是___;电极X是原电池的___极;
(2)银电极发生的电极反应为___;
(3)今有2H2+O2![]() 2H2O反应构成燃料电池,则正极通的应是___;负极的电极反应式为___。
2H2O反应构成燃料电池,则正极通的应是___;负极的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。回答下列问题:
(1)Mg、Ni、Cu 等金属可能形成金属互化物。金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、 “等于”或“小于”),理由是_____________________。
(3)[Ni(NH3)6](NO3)2 中不存在的化学键为___________(填序号)。
a.离子键 b.金属键 c.配位键 d.氢键
(4)镍基合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。
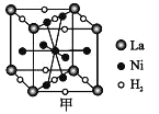
该合金储氢后,H2 与 Ni 的物质的量之比为___________。
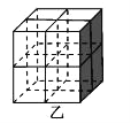
②Mg2NiH4 是一种储氢的金属氢化物。在 Mg2NiH4 晶胞中,Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于 Ni 原子形成的___________ (填“八面体空隙”或“四面体空隙”)。 晶体的密度为ρg·cm-3,NA表示阿伏加德罗常数,Mg2+和 Ni 原子的最短距离为__________cm(用含ρ和 NA 的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是重要的基本化工原料,可用于生产聚乙烯、乙醇等。
(1)工业上乙烯主要是由石油加工得到,由石油制得乙烯的方法是 __________(填序号)。
a.分馏 b.裂化 c.裂解 d.干馏
(2)聚乙烯是一种用途广泛的塑料,由乙烯制取聚乙烯的化学方程式:___________。
(3)在工业上,乙醇可由乙烯与水发生加成反应制得,其反应的化学方程式__________。
(4)某烯烃 A 进行如下反应,A、D 所有碳原子处于同一平面,D、E 互为同分异构体。
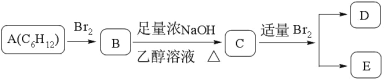
①A 的结构简式为___________。
②B 生成 C 的化学方程式为__________, 反应类型为___________。
③C 生成 D 的化学方程式:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸在生活和生产中应用广泛。
Ⅰ 某工厂以黄铁矿(主要成分为FeS2)为原料,采用“接触法”制备硫酸。
已知298 K和101 kPa条件下:
2FeS2(s)=2FeS(s)+S(s) ΔH1
S(s)+2O2(g)=2SO2(g) ΔH2
4FeS(s)+7O2(g)=2Fe2O3(s)+4SO2(g) ΔH3
则在该条件下FeS2与O2生成Fe2O3和SO2的总热化学方程式是________。
Ⅱ 催化氧化反应:2SO2(g)+O2(g)2SO3(g) ΔH<0
(1) 在体积可变的密闭容器,维持压强为1×105 Pa和初始n(SO2)=2 mol,充入一定量的O2,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
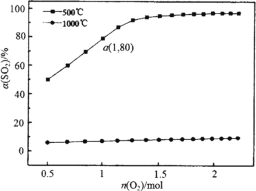
①在1000℃时,SO2平衡转化率随着O2物质的量的增大缓慢升高,解释其原因________。
②a点时SO3的平衡分压p(SO3)=________Pa(保留2位有效数字,某组分的平衡分压=总压×某组分的物质的量分数)。
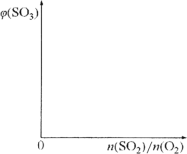
(2)保持温度不变,向固定体积的密闭容器中充入一定量的SO2、O2。请画出平衡体系中SO3的体积分数φ(SO3)随初始SO2、O2的物质的量之比[n(SO2)/n(O2)]的变化趋势图。
(3)已知活化氧可以把SO2快速氧化为SO3。根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化如图所示。下列说法正确的是________。
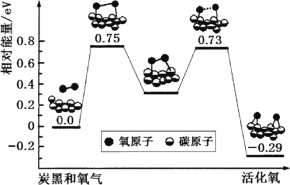
A O2转化为活化氧是氧氧键的断裂与碳氧键的生成过程
B 该过程中最大能垒(活化能)E正=0.73 eV
C 每活化一个O2吸收0.29 eV的能量
D 炭黑可作为SO2转化为SO3的催化剂
E 其它条件相同时,炭黑颗粒越小,反应速率越快
Ⅲ 硫酸工厂尾气中的SO2可被NaOH溶液吸收,用惰性电极将所得的Na2SO3溶液进行电解,可循环再生NaOH的同时得到H2SO4,写出阳极的电极方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】GaAs 晶体的熔点很高,硬度很大,密度为ρ gcm-3,Ga和 As的摩尔质量分别为 MGa gmol-1 和 MAsgmol-1,原子半径分别为 rGa pm 和 rAs pm,阿伏加德罗常数值为 NA,其晶胞结构如图所示,下列说法错误的是
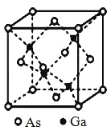
A.该晶体为共价晶体
B.该晶体中 Ga 和 As 均无孤对电子,Ga 和 As 的配位数均为 4
C.原子的体积占晶胞体积的百分率为![]()
D.所有原子均满足 8 电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.分子式 C8H10 的苯的同系物共有 3 种结构
B.![]() 与
与![]() 互为同系物
互为同系物
C.三联苯(![]() )的一氯代物有 4 种
)的一氯代物有 4 种
D.立方烷(![]() )经硝化可得到六硝基立方烷,其可能的结构有 3 种
)经硝化可得到六硝基立方烷,其可能的结构有 3 种
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以金属镍废料(除NiO外,还含有少量的FeO、Fe2O3) 为原料生产Ni2O3的流程如下:
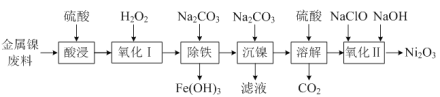
(1) “酸浸”时,Fe2O3发生反应的化学方程式为_____。
(2) “氧化Ⅰ”时,加入双氧水的目的是_____。
(3) “沉镍”时,检验Ni2+沉淀完全的操作是_____。
(4) “氧化Ⅱ”时,发生反应的离子方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室回收废水中苯酚的过程如图所示。下列分析错误的是
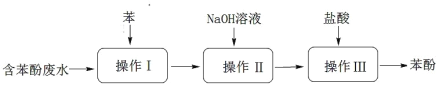
A.操作Ⅰ为萃取、分液,萃取剂也可以用选用 CCl4
B.苯酚钠是离子化合物,在苯中的溶解度比在水中的小
C.通过操作Ⅱ,苯可循环使用,三步操作均需要分液漏斗
D.苯酚沾到皮肤上,需用 NaOH 溶液清洗后,再用大量水不断冲洗
查看答案和解析>>
科目: 来源: 题型:
【题目】临床证明磷酸氯喹对治疗“新冠肺炎”有良好的疗效。磷酸氯喹的结构如图所示。下列有关磷酸氯喹的说法错误的是( )
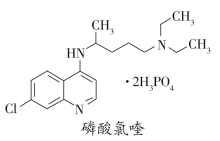
A.分子式是C18H32ClN3O8P2
B.能发生取代、加成和消去反应
C.1mol磷酸氯喹最多能与5molH2发生加成反应
D.分子中的—C1被—OH取代后的产物能与溴水作用生成沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是_________。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:____________________________________________________________________。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有________________(填化学性质)。
(3) 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:_____Fe(OH)3+_____ClO-+_________=_____FeO42-+_____Cl-+_________
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
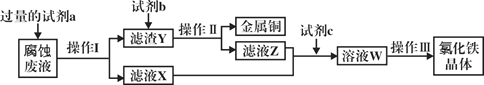
回答下列问题:
①试剂a是___________,操作I用到的玻璃仪器有烧杯、玻璃棒和___________。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________。
③上述流程中操作III包括________________、________________、过滤、洗涤。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com