
科目: 来源: 题型:
【题目】某小组为研究电化学原理,设计了如图所示装置。
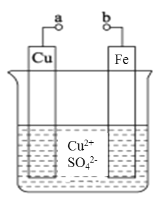
下列叙述不正确的是
A.a和b不连接时,Fe片上会有金属 Cu析出
B.a和b用导线连接时,Cu 片上发生的反应为Cu2++2e- =Cu
C.a和b导线连接时,电子从Fe 电极经溶液流向Cu电极
D.a和b用导线连接后.电流由Fe电极经导线流向Cu 电极
查看答案和解析>>
科目: 来源: 题型:
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
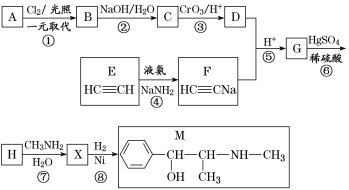
已知:Ⅰ.芳香烃A的相对分子质量为92
Ⅱ.R—CH2OH![]() RCHO
RCHO
III、R1-CHO+
IV、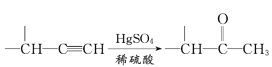
V、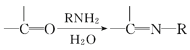
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Z、Y为核电荷数依次增大的前20号主族元素,W的原子中只有1个电子,X与Y同族,Y的一种单质在空气中易自燃,W与Z形成的二元化合物和水反应可生成W的单质。下列说法正确的是![]()
A.W分别与Y、Z形成的化合物中化学键类型相同
B.Y的氧化物的水化物是强酸
C.氢化物沸点:![]()
D.简单离子半径:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】RbH是一种离子化合物,它跟水反应的方程式为:![]() ,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气,下列有关RbH的叙述错误的是
,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气,下列有关RbH的叙述错误的是![]()
A.灼烧RbH时,火焰有特殊颜色
B.RbH中![]() 半径比
半径比![]() 半径小
半径小
C.跟液氨反应时,有![]() 生成
生成
D.在Na、K、Rb三种单质中,Rb的熔点最低
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W为短周期主族元素,原子序数依次增大,X原子的最外层电子数是第一层电子数的2倍,Y的气态氢化物与最高价氧化物的水化物可形成盐,Z的最外层电子数与其电子总数比为3:8,下列说法正确的是![]()
A.X、Y、W的最高价含氧酸酸性顺序:![]()
B.Z、W可形成![]() 的化合物,属于离子化合物
的化合物,属于离子化合物
C.离子半径:![]()
D.气态氢化物的稳定性:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组按如下流程,进行海带中碘含量的测定和碘的制取等实验。
I. 碘含量的测定

(1)步骤①是将海带置于__________中(填仪器名称)进行灼烧。
(2)步骤④是将溶液转移至________________(填定容仪器的名称)。
(3)取20.00mL 上述海带浸取原液,加稀H2SO4和足量KIO3,使![]() 和
和![]() 完全反应(
完全反应(![]() )。再以淀粉为指示剂,用
)。再以淀粉为指示剂,用![]() mol/L的Na2S2O3溶液滴定(
mol/L的Na2S2O3溶液滴定(![]() ),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
(4)判断用Na2S2O3溶液滴定恰好完全反应的现象是__________________________。
(5)计算该干海带中碘的质量分数_________________。
II. 碘的制取
另制海带浸取原液,按如下方案制取碘:
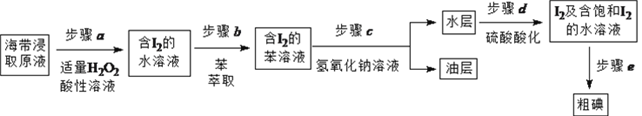
(1)补全步骤![]() 的反应方程式,配平并标出电子转移的数目和方向。
的反应方程式,配平并标出电子转移的数目和方向。
![]() ,_______________
,_______________
(2)步骤![]() 加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
(3)步骤![]() 的操作是_______________。
的操作是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是透明、浅蓝绿色晶体,易溶于水而不溶于酒精等有机溶剂,在空气中一般比较稳定,不易被氧化。制备步骤如下:
步骤1.称取还原铁粉0.4g,炭粉0.3g,放入50mL 锥形瓶中,加入3.5 mL2mol·L-1硫酸置于60℃ 热水浴中加热(如下左图),待反应完全,取出冷却,再加入6 mol·L-1的硫酸2 mL。

步骤2.在上述反应液中加入浓氨水0.8 mL,振荡混匀,抽滤(如上右图)。向滤液中加入10mL无水乙醇,静置,大量晶体析出,倾析,再次抽滤。
步骤3.取出晶体,用干净的滤纸吸干,称量并分析样品。
请回答下列问题:
(1)步骤1中炭粉的作用是_______,加人6 mol·L-1硫酸的作用是____________。
(2)向滤液中加人无水乙醇目的是_________________。
(3)产品中金属阳离子的检验方法及现象________________。
(4)称取获得的硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](摩尔质量为392g·mol-1)1.9600 g 配成100mL溶液,取出20.00mL滴加稀H2SO4酸化后用0 . 0100 mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液为18.00mL 。
下列有关滴定的操作正确的是_(填字母编号)。
a.滴定过程中眼睛注视滴定管中液面变化
b.滴定完成后取下滴定管握住中部防止掉落
c.读数过程中保持滴定管自然悬垂
d.读数时视线与刻度线、凹液面最低处切线相平齐
滴定过程中反应离子方程式为____________,制得硫酸亚铁钱样品的纯度为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是( )
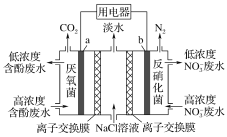
A.a极为正极,发生氧化反应
B.b极的电极反应式为:2NO![]() +12H+-10e-=N2↑+6H2O
+12H+-10e-=N2↑+6H2O
C.中间室的Cl-向左室移动
D.左室消耗苯酚(C6H5OH)9.4 g时,用电器流过2.4 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com