
科目: 来源: 题型:
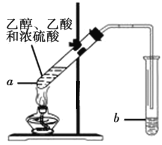
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.
 ℃
℃
(1)写出实验室制备乙酸乙酯的化学方程式_________
(2)步骤②中b试管中饱和Na2CO3溶液的主要作用_______(填字母)
a.降低乙酸乙酯的溶解度
b.除去实验中挥发出来的硫酸
c.除去乙酸乙酯中混有的乙酸和乙醇
(3)试管b中盛放的试剂_________(填“能”或“不能”)换成NaOH溶液
(4)连接好装置(装置气密性良好),用小火均匀地加热装有混合液的试管a3~5min,需要用小火均匀加热,其主要原因是________
查看答案和解析>>
科目: 来源: 题型:
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是( )
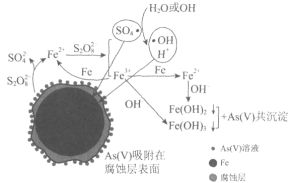
A.1mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56gFe参加反应,共有NA个S2O82-被还原
C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)为2.7×10-18mol·L-1
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)2SO3(g);ΔH=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol。请填写下列空白:
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)_________
A.容器内压强不再发生变化B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化D.容器内气体密度不再发生变化
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为___________;反应放出的热量为_____kJ。
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是______。
A.向容器中通入少量O2B.向容器中通入少量SO2C.使用催化剂D.降低温度E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据官能团的不同对下列有机物进行分类。把正确答案的序号填写在题中的横线上。
①CH3CH2OH②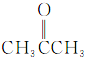 ③
③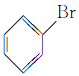 ④
④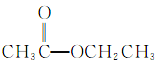 ⑤
⑤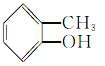 ⑥
⑥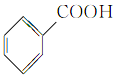 ⑦
⑦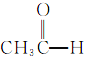 ⑧
⑧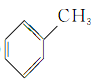
(1)芳香烃:__;(2)卤代烃:__;
(3)醇:__;(4)酚:___;
(5)醛:___;(6)酮:___;
(7)羧酸:__;(8)酯:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H溴丙胺太林(普鲁本辛)属于抗胆碱类药物,用于胃和十二指肠溃疡的辅助治疗,亦用于胃炎、胰腺炎。某合成路线如下:
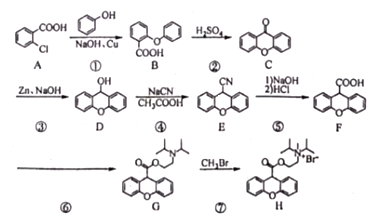
回答下列问题:
(1)A的化学名称为__________,E的分子式为__________________。
(2)①的反应类型为_____________。
(3)反应⑥的化学方程式为________________________________________________。
(4)H中含氧官能团的名称是_____________。
(5)N是D的同分异构体,含有联苯(![]() )结构,可与银氨溶液发生银镜反应,与
)结构,可与银氨溶液发生银镜反应,与![]() 溶液发生显色反应。符合该条件的D共有___________种;其中核磁共振氢谱为六组,峰面积比为1:2:2:2:2:1的结构简式为____________________________。
溶液发生显色反应。符合该条件的D共有___________种;其中核磁共振氢谱为六组,峰面积比为1:2:2:2:2:1的结构简式为____________________________。
(6)苯乙酸乙酯为合成香料,用于配制各种花香型日用香精。其一种合成路线为:

条件a为__________________,最后一步反应,乙醇稍过量的目的是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A充分燃烧消耗氧气的量不相等的是(填序号)_______。
A. C7H12O2 B.C6H14 C.C6H14O D. C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则A的结构简式为_____________。
(3)若链烃A的分子结构中有三种氢原子,个数比为3:2:1,则A的名称为________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、N是短周期元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大。Z和N可以形成ZN2型化合物。回答下列问题:
(1)元素N在周期表中的位置_______,它的最高价氧化物的化学式为________。
(2)用电子式表示ZN2的形成过程________。
(3)Z能在氮气中燃烧,Z在氮气中燃烧的产物与水反应可产生一种使湿润红色石蕊试纸变蓝的气体。写出Z在氮气中的燃烧产物与水反应的化学方程式:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】巨豆三烯酮(F)是一种重要的香料,其合成路线如下:
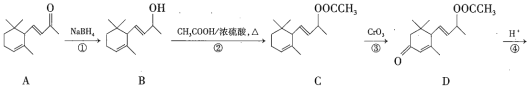
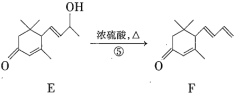
(1)化合物F的分子式为_____________,1mol该物质完全燃烧需消耗________molO2。
(2)在上述转化过程中,反应②的目的是______________,写出反应②的化学方程式:_______________。
(3)下列说法正确的是___________(填序号)。
A.化合物A~F均属于芳香烃的衍生物 B.反应①属于还原反应
C.1mol化合物D可以跟4molH2发生反应 D.化合物F中所含官能团的名称为碳碳双键、羰基
(4)符合下列条件的D的同分异构体有两种,其中一种同分异构体的结构简式如下图所示,请写出另一种同分异构体的结构简式:__________________。
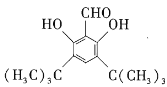
a.属于芳香化合物 b.核磁共振氢谱显示,分子中有4种不同类型的氢原子
c. 1mol该物质最多可消耗2mol NaOH d.能发生银镜反应
查看答案和解析>>
科目: 来源: 题型:
【题目】美国科学家JohnB.Goodenough荣获2019年诺贝尔化学奖,他指出固态体系锂电池是锂电池未来发展方向。Kumar等人首次研究了固态可充电、安全性能优异的锂空气电池,其结构如图所示。已知单位质量的电极材料放出电能的大小称为电池的比能量。下列说法错误的是( )
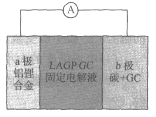
A.a极反应为“Li-e-=Li+,b极发生还原反应
B.充电时,Li+由a极通过固体电解液向b极移动
C.电路中转移4mol电子,大约需要标准状况下112L空气
D.与铅蓄电池相比,该电池的比能量大
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙各取300 mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末进行下列实验,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
(标准状况)气体体积/mL | 560 | 672 | 672 |
求:(1)盐酸的物质的量浓度是多少________?
(2)合金中镁铝的质量分数各是多少________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com