
科目: 来源: 题型:
【题目】对下列叙述的评价合理的是
选项 | 叙述 | 评价 |
A | 乙酸乙酯在H | 对,根据酯的水解规律,产物乙醇中将含有18O同位素,而乙酸则没有 |
B | 明矾和漂白粉都可用于水的净化 | 对,二者的作用原理相同 |
C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | 对,K2CO3与NH4Cl反应生成氨气会降低肥效 |
D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇、乙酸和葡萄糖 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇和乙酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐(已知:25℃,Ka(CH3COOH)=1.69×10-5)。
(1)醋酸钠溶液呈碱性的原因是_______________(写出有关的离子方程式)
(2)在CH3COONa溶液中离子浓度由大到小的顺序为_____________________(用c(Bn+)表示相应离子浓度);
(3)25℃时,0.10mol/L的醋酸溶液的pH约为___________(已知:lg1.3=0.114);
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小.
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解.
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离.
D.醋酸和醋酸钠混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离.
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是_______;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(6)常温时,有以下3种溶液,其中pH最小的是____________;
A.0.02molL-1CH3COOH与0.02molL-1NaOH溶液等体积混合液
B.0.03molL-1CH3COOH与0.01molL-1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(7)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸钠溶液,则pH(CH3COONa)_______ pH(Na2CO3).(填:“>”、“<”或“=”)
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法中正确的是( )
A. 5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
B. 常温常压下,ag某气体含分子数为b,则cg该气体的体积为![]()
C. 2mol/L的CaCl2溶液中Cl-的数目为4NA
D. 46g NO2和N2O4的混合气体中含有的氧原子个数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】LiCoO2是锂离子电池最早使用的电极材料,利用原钴矿(含Cr2O3、NiS等杂质)制备LiCoO2的工艺流程如下:
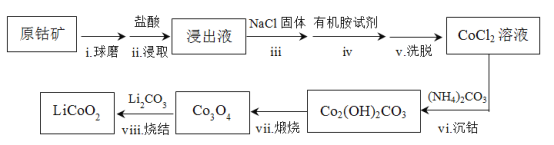
资料:i. 在含一定量Cl的溶液中,钴离子以CoCl42-形式存在:Co2++4Cl![]() CoCl42
CoCl42
ii. CoCl42溶于有机胺试剂,有机胺不溶于水。
iii. 盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
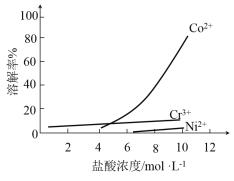
(1)步骤ii选用盐酸的浓度应为__________。
a. 4 mol/L b. 6 mol/L c. 10 mol/L
(2)从平衡移动角度解释步骤ⅲ中加入NaCl固体的目的_____________。
(3)步骤iv的操作是_______。
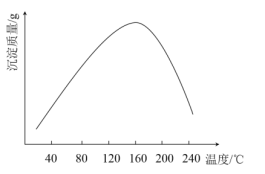
(4)步骤vi用(NH4)2CO3作沉淀剂,在一定条件下得到碱式碳酸钴(Co2(OH)2CO3)。实验测得在一段时间内加入等量(NH4)2CO3所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因____________。
(5)步骤viii中Co3O4 和Li2CO3 混合后,鼓入空气,经高温烧结得到LiCoO2。该反应的化学方程式是_____________。
(6)锂离子电池的工作原理如图,充、放电过程中,Li+在LiCoO2电极和碳电极之间传递。电池的总反应为:LixC + Li1-xCoO2 ![]() C+LiCoO2
C+LiCoO2
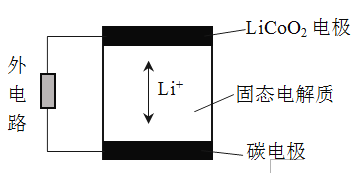
①放电时,电池的负极是______。
②充电时,电池的阴极反应式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目: 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目: 来源: 题型:
【题目】水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
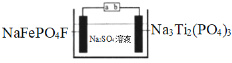
下列说法错误的是
A.充电时,a接电源正极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LH2O中含有的质子数目为5NA
B.80mL10mol·L-1盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA
C.标况下11.2LNO和11.2LO2混合后所得气体分子数为NA
D.KClO3+6HCl=KCl+3Cl2↑+3H2O生成3molCl2转移5mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.中和热测定实验中需要的玻璃仪器有:烧杯、量筒、温度计、环形玻璃搅拌棒
B.乙烯的燃烧热为1411.3 kJ·mol1,则乙烯燃烧的热化学方程式为C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(g) ΔH= 1411.3 kJ·mol1
2CO2(g)+2H2O(g) ΔH= 1411.3 kJ·mol1
C.用石墨电极电解1 L 0.1 mol·L1 CuSO4溶液,若反应产生0.1 mol O2,则向原溶液中加入0.2 mol CuO能恢复至原浓度
D.用pH试纸分别测定氯水和盐酸的pH,比较两溶液的酸性强弱
查看答案和解析>>
科目: 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A. 简单离子半径:b>e
B. 常温常压下,a与c形成的化合物可能呈固态
C. 单质沸点:c<d
D. d与e不能存在于同一离子化合物中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com