
科目: 来源: 题型:
【题目】某含Cr2O72-废水用硫酸亚铁铵[FeSO4(NH4)2SO46H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到nmolFeOFeyCrxO3(提示:其中Cr为+3价)。不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物质的量为n(3x+l)mol
B.处理废水中Cr2O72-的物质的量为(nx/2)mol
C.反应中发生转移的电子的物质的量为6nxmol
D.在FeOFeyCrxO3中3x=y
查看答案和解析>>
科目: 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=![]() ,恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
,恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A.降低温度,正反应速率增大
B.增大c(A)、c(B),K增大
C.向容器中充入稀有气体X,压强增大,反应速率不变
D.该反应的化学方程式为2E(g)+F(s)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是
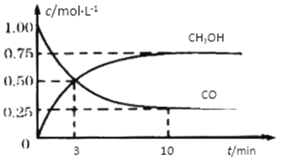
A.反应的化学方程式:CO+2H2![]() CH3OH
CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO) = 0.075 mol/L·min
D.增大压强,平衡正向移动,K不变
查看答案和解析>>
科目: 来源: 题型:
【题目】石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。 制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:
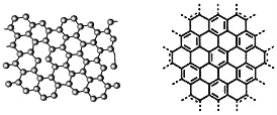
(1)下列有关石墨烯说法正确的是_____。
A 石墨烯的结构与金刚石相似 B 石墨烯分子中所有原子可以处于同一平面
C 12g 石墨烯含σ键数为 NA D 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含 碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为:_____。
②乙醇沸点比氯乙烷高,主要原因是___________________。
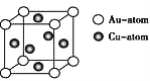
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:_______ 。
④含碳源中属于非极性分子的是______________(填序号)
a 甲烷 b 乙炔 c 苯 d 乙醇
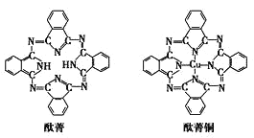
⑤酞菁与酞菁铜染料分子结构如下图,组成酞菁铜染料分子的元素,酞菁变成酞菁铜,分子中多 了什么作用力_____,酞菁铜分子中设计到的元素,电负性由小到大依次为_____
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,将2molSO2和1molO2冲入10L恒温密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)ΔH═-196kJ/mol,5min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A.0~5min内,用O2表示的平均反应速率υ(O2)═0.017mol·(L·min)-1
B.条件不变,起始时向容器中冲入4molSO2和2molO2,平衡时反应放热小于333.2kJ
C.若增大O2的浓度,则SO2的转化率增大
D.![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下:
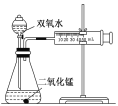
分析表中数据回答下列问题:
MnO2 时间 H2O2 | 0.1g | 0.3g | 0.8g |
10mL1.5% | 223s | 67s | 56s |
10mL3.0% | 308s | 109s | 98s |
10mL4.5% | 395s | 149s | 116s |
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是__________________________________。
(4)为加快过氧化氢的分解速率,除了使用MnO2作催化剂和改变过氧化氢的质量分数之外,还可以采取的加快反应速率的措施有_____。(回答任意两个合理的措施)
查看答案和解析>>
科目: 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式:2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) /mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO) /mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的![]() ___0(填写“>”、“<”、“=”)。
___0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)计算4s时NO的转化率为____________。
(4)下列措施能提高NO和CO转变成CO2和N2的反应速率的是______(填序号)。
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)由上表数据可知,该反应在第______s达到化学平衡状态。假如上述反应在密闭恒容容器中进行,判断该反应是否达到平衡的依据为________(填序号)。
A.压强不随时间改变B.气体的密度不随时间改变
C.c(NO)不随时间改变D.单位时间里消耗NO和CO的物质的量相等
(6)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2·g-1 |
Ⅰ | 280 | 1.20×10-3 | 82 | |
Ⅱ | 5.80×10-3 | 124 | ||
Ⅲ | 350 | 124 |
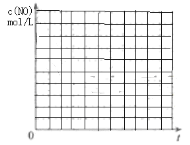
①请在上表格中填入剩余的实验条件数据_____、_____、______、______、______。
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容容器中进行如下反应:N2+3H2![]() 2NH3 △H<0,温度一定时,若将平衡体系中各物质的浓度都增加到原来的2倍,不会产生的结果是( )
2NH3 △H<0,温度一定时,若将平衡体系中各物质的浓度都增加到原来的2倍,不会产生的结果是( )
A. 平衡向正反应方向移动B. 平衡向逆反应方向移动
C. NH3的百分含量增加D. 正、逆反应速率都增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O![]() HSO3-十OH—B.HSO3-十H2O
HSO3-十OH—B.HSO3-十H2O![]() H2SO3十OH-
H2SO3十OH-
C.HSO3-十OH—![]() SO32—十H2OD.H2SO3+OH-
SO32—十H2OD.H2SO3+OH-![]() HSO3-十H2O
HSO3-十H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属.试回答:
(1)B在周期表中的位置是_________ ; C的元素名称为______.
(2)在五种元素中,能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是______ (用具体的分子式表示).
(3)A与B形成的三原子分子的结构式是______,B与D形成的原子个数比为1:1的化合物的电子式是______.
(4)写一个由以上5种元素中部分元素形成的物质的发生置换反应的方程式_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com