
科目: 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
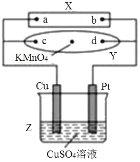
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬致密,耐腐蚀的氧化膜。下列有关叙述正确的是

A. 阴极上有金属铝生成
B. 电极A为石墨,电极B为金属铝
C. OH-在电极A上放电,有氧气生成
D. 阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象。_______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
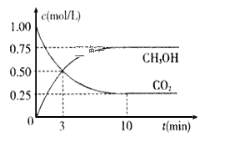
(1)写出该反应的平衡常数表达式_____________________。
(2)达到平衡状态的时刻是__________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=_________mol/(L·min)。
(CO2)=_________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为____________。
(5)该温度下,反应的化学平衡常数数值是____________。
(6)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)
CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_______________,反应在10 min内所放出的热量为_____kJ。
CO2(g)+H2(g) ΔH=-41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_______________,反应在10 min内所放出的热量为_____kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烧碱样品因部分变质含Na2CO3。某化学课外小组的同学用滴定法测定该烧碱样品中NaOH的质量分数。
(资料)常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2 无色 8.2<pH<10浅红色 pH>10 红色
甲基橙:pH<3.1红色 3.1<pH<4.4橙色 pH>4.4 黄色
(实验步骤)
I. 迅速地称取烧碱样品0.50g,溶解后配制成100 mL溶液,备用。
Ⅱ.将0.1000mol/L HCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取20.00 mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和NaHCO3),记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如下:
实验序号 | 1 | 2 | 3 |
V0/ mL | 0.00 | 0.00 | 0.00 |
V1/ mL | 21.72 | 21.68 | 21.70 |
V2/ mL | 23.72 | 23.68 | 23.70 |
(1)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和________。
(2)下列有关步骤I中样品溶液的说法正确的是________(填字母序号)。
a. 样品溶液中水的电离程度比相同pH的NaOH溶液中的小
b. c(OH-)>c(CO32-)>c(HCO3-)
c. c(H+)+ c(Na+)=c(CO32-)+c(HCO3-)+ c(OH-)
d. 向该溶液中滴加盐酸至第一终点时,n(Cl-)+n(CO32-)+n( HCO3-)+n(H2CO3)=n(Na+)
(3)酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是_______。
(4)滴定至第一终点的过程中,发生反应的离子方程式为_____。
(5)判断滴定至第二终点的现象是溶液由___色变为橙色。
(6)样品中NaOH的质量分数w(NaOH)= _____%。(计算结果保留小数点后1位)
(7)下列操作会导致测得的NaOH质量分数偏高的是____(填字母序号)。
a. 达到第一终点前,锥形瓶中有气泡产生
b. 记录酸式滴定管读数V1时,俯视标准液液面
c. 第一终点后继续滴定时,锥形瓶中有少许液体溅出
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A消耗氧气的量不相等的是(填序号)_____。
A.C7H12O2 B.C6H14 C.C6H14O D.C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为______________。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为____。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_____________.
(II)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | A的相对分子质量为:_____。 |
(2)将此4.5gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g | A的分子式为:________。 |
(3)另取A4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2(标准状况),若与足量金属钠反应则生成1.12LH2(标准状况) | 写出A中含有的官能团____________、________。 |
(4)A的核磁共振氢谱如下图: | 综上所述,A的结构简式为________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】锌银电池的负极为锌,正极为氧化银,电解质是KOH,电池反应为Zn+Ag2O+H2O![]() Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。
Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。
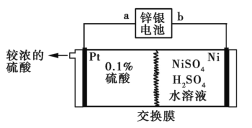
下列说法正确的是
A.装置中使用阳离子交换膜
B.锌银电池a极反应式为Ag2O+H2O+2e-![]() 2Ag+2OH-
2Ag+2OH-
C.镍极的主要反应为2H++2e-![]() H2↑
H2↑
D.若锌银电池溶解13 g锌,则镍极净增质量最多为5.9 g
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中两个变化所发生的反应,属于同一类型的是
A.由苯制硝基苯、由乙醇制取乙酸乙酯
B.乙烯使溴的CCl4溶液褪色、甲苯使酸性高锰酸钾水溶液褪色
C.由HO-CH2-COOH制![]() 、由氯乙烯制聚氯乙烯
、由氯乙烯制聚氯乙烯
D.由氯乙烷制乙烯、由溴乙烷制乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com