
科目: 来源: 题型:
【题目】石嘴山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l)的ΔH=______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为______。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106 Pa时,该反应的化学平衡常数Kp=____[已知:气体分压(P分)=气体总压(P)×体积分数]。
(5)汽车尾气还可利用反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,质量为m的气体A与质量为n的气体B的分子数相同,下列说法中不正确的是( )
A.气体A与气体B的相对分子质量比为m:n
B.同质量气体A与气体B的分子个数比为n:m
C.同温同压下,A气体与B气体的密度比为n:m
D.相同状况下,同体积的A气体与B气体的质量比为m:n
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A2(g)+B2(g) →2AB(g)的能量变化如图所示,叙述正确的是

A. 该反应是放热反应
B. 加入催化剂,(b-a)的差值减小
C. 每生成2molAB分子吸收bkJ热量
D. 若反应生成AB为液态,吸收的热量小于(a-b)kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应X(g) + Y![]() Z(g)中,其中Z是有色气体,当达到平衡时,下列叙述正确的是
Z(g)中,其中Z是有色气体,当达到平衡时,下列叙述正确的是
A.增大压强,平衡体系颜色加深,说明Y必是气体
B.增大压强,当c(X)= c(Z) 时,则再次达到平衡
C.若Y是气体,增大X的浓度会使Y的转化率增大,化学平衡常数也增大
D.升温,Z的质量分数减小,说明正反应是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C是中学化学中最常见的三种有机物,D是高分子化合物,常用来制造食品和药品包装袋,已知这四种物质之间存在如图所示关系:
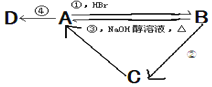
(1)写出反应类型:①___,③____,④____。
(2)反应②的条件是____。
(3)写出化学方程式:B→C:___,A→D:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的价电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中SO42-的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______ ,提供空轨道的中心微粒是_____。
③氨的沸点_____(“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
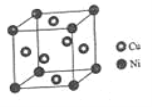
①晶胞中镍原子与铜原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 1L1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B. 常温常压下,14g由乙烯与丙烯组成的混合气体含有的原子数目为3NA
C. 1mol·L-1醋酸溶液中所含CH3COOH分子总数一定小于NA
D. 标准状况下,11.2L己烯中含有的碳原子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A. 当有0.8mol电子转移时,b极产生4.48LO2
B. 为了增加导电性可以将左边容器中的水改为NaOH溶液
C. d极上发生的电极反应是:2H+ +2e-=H2
D. c极上进行氧化反应,A池中的H+可以通过隔膜进入B
查看答案和解析>>
科目: 来源: 题型:
【题目】I.在最新的家用汽车的调查中发现,新车中气体的质量不符合标准.汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物.其中一种有毒物质A,为了测定有机物A的结构,做如下实验:
①将9.2g该有机物完全燃烧,生成标况下15.68L的CO2和7.2g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
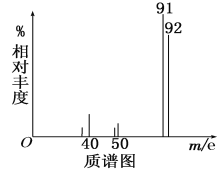
则由图可知该分子的相对分子质量是________,有机物A的分子式为_________。
II. 已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G,以A为原料的合成路线如下图所示。回答下列问题:

(1)写出②、④ 、⑤两步反应的化学方程式,并注明反应类型:
②_____________________,反应类型__________。
④______________________,反应类型_________。
⑤_______________________,反应类型_________。
(2)写出由C与新制氢氧化铜反应的化学方程式及实验现象:_________________;_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com