
科目: 来源: 题型:
【题目】在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)![]() X(g)+Y(g) △H;所得实验数据如表所示:
X(g)+Y(g) △H;所得实验数据如表所示:
实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
① | 300 | 2.00 | 2.80 |
② | 400 | 2.00 | 3.00 |
③ | 400 | 4.00 | a |
下列推断正确的是( )
A.上述反应中,△H<0
B.实验②中,该反应的平衡常数K=0.5
C.实验①经4min达到平衡,0~4 min内υ(X)=0.2mol·L-1·min-1
D.实验③中a=6.00
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验能达到预期目的是
A.测同温同浓度下的![]() 和
和![]() 水溶液的pH,确定碳和硫两元素非金属性强弱
水溶液的pH,确定碳和硫两元素非金属性强弱
B.向煮沸的1![]() NaOH溶液中滴加
NaOH溶液中滴加![]() 饱和溶液制备
饱和溶液制备![]() 胶体
胶体
C.用乙醇萃取碘水中的碘
D.证明铁的生锈与空气有关,可用图装置来证明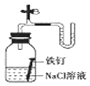
查看答案和解析>>
科目: 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。SiO2的晶体类型为_____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是___________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z为三种元素,X能与氢形成气态XH4,其中X的质量分数为75%;且X与Y能形成XY2型化合物。Y的原子核内质子数和中子数相等,在Y的氢化物中,Y的质量分数为88.9%。Z的最高价氧化物的水化物是酸性最强的酸。
(1)X的单质叫做______,它属于______晶体。
(2)Y的氢化物属于______晶体,它的电子式是______。
(3)Z元素位于周期表的第______周期______族,它的氢化物是______性分子。
(4)X与Z形成的化合物可用电子式表示为______,其分子的空间构型是______体,属于______性分子,它的晶体属于______晶体。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。
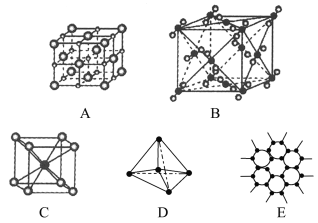
(1)其中代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表石墨的是________,其中每个正六边形占有碳原子数平均为________个。
(3)其中代表NaCl晶体的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl晶体的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
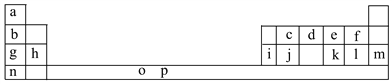
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___________________。
(2)d与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是__________________________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
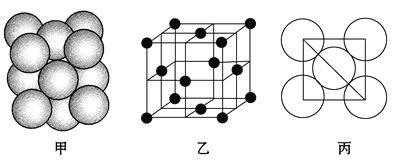
请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁氮化合物(![]() )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某![]() 的制备需铁、氮气、丙酮和乙醇参与。
的制备需铁、氮气、丙酮和乙醇参与。
(1)![]() 基态核外电子排布式为_______。
基态核外电子排布式为_______。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为______________。
(3)C、H、O三种元素的电负性由小到大的顺序为_____。
(4)乙醇的沸点高于丙酮,这是因为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 铁表面镀铜时,将铁与电源的正极相连,铜与电源的负极相连
B. 0.01 mol Cl2通入足量水中,转移电子的数目为6.02×1021
C. 反应3C(s)+CaO(s)===CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的ΔH>0
D. 加水稀释0.1 mol·L-1CH3COOH溶液,溶液中所有离子的浓度均减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)![]() 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,![]() 的值增大
的值增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作中错误的是
A.溴苯中含有溴单质,可用NaOH溶液洗涤,再经分液而除去
B.除去苯中的少量苯酚:加入NaOH溶液、振荡、静置分层后,除去水层
C.除去乙酸乙酯中少量的乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯
D.用![]() 溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀
溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com