
科目: 来源: 题型:
【题目】已知H+可以写成H3O+,从某些性质看,NH3和H2O,![]() 和H3O+,OH-和
和H3O+,OH-和![]() ,N3-和O2-两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
,N3-和O2-两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
①2Na+2NH3=2NaNH2+H2↑
②CaO+2NH4Cl=CaCl2+2NH3↑+H2O
③3Mg(NH2)2=Mg3N2+4NH3↑
④NH4Cl+NaNH2=NaCl+2NH3↑
A.①B.②④C.全部D.①②④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组都为两种化合物溶于水时电离出的离子:①Na+、OH-、![]() ,②H+、Cl-、
,②H+、Cl-、![]() ,③Na+、K+、OH-,④Na+、K+、
,③Na+、K+、OH-,④Na+、K+、![]() ,其中按照仅由酸、碱、盐依次电离的是( )
,其中按照仅由酸、碱、盐依次电离的是( )
A. ②③④ B. ②①④
C. ②③① D. ②①③
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定碳酸钠纯度(只含有少量氯化钠),学生设计了如下两个实验方案。
[方案1]称取![]() 样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
(1)写出生成沉淀的反应方程式__________________。
(2)过滤操作需要的玻璃仪器__________________。
(3)计算碳酸钠的质量分数为______________(保留两位小数)。
[方案2]用下图装置,排液法测定![]() 的体积,并根据样品质量和
的体积,并根据样品质量和![]() 的体积计算
的体积计算
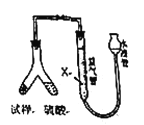
(4)为了减小测定![]() 的体积误差,量气管中加入的液体
的体积误差,量气管中加入的液体![]() 为______(填化学式)。
为______(填化学式)。
(5)通过实验,测得该试样中碳酸钠的质量分数偏高,产生这种现象的原因可能是______。
A.测定气体体积时未冷却至室温
B.气体进入量气管前未用浓硫酸干燥
C.![]() 型管中留有反应生成的气体
型管中留有反应生成的气体
D.反应结束后读数时水准管的水面高于量气管的水面
查看答案和解析>>
科目: 来源: 题型:
【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号”高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是______,属于金属材料的是______(写一种即可)。
(2)飞机外壳用钛合金、铝合金的优点是______。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。写出该反应的化学方程式为______,反应基本类型是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,0.1000mol·L-1的盐酸逐滴加入到20.00mL 0.1000mol·L-1的氨水中,溶液的pH和pOH[注:pOH=-lgc(OH-)]与所加盐酸体积的关系如图所示,下列说法中不正确的是( )
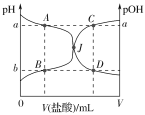
A.图中a+b=14
B.交点J点对应的V(HCl)=20.00 mL
C.点A、B、C、D四点的溶液中均存在如下关系:c(Cl-)-c(NH4+)=c(H+)-c(OH-)
D.若在绝热体系中发生上述反应,图中的交点J向右移
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(Ⅰ)
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
查看答案和解析>>
科目: 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO和N2O4的混合气体1120mL (标推状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A. 该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
B. 该合金中铜与镁的物质的量之比是2:1
C. NO2和N2O4的混合气体中,NO的体积分数是20%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600mL
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
A. 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol
B. 改变温度,产物中NaCl的最小理论产量为4a mol
C. 参加反应的氯气的物质的量为6a mol
D. 某温度下,若反应后![]() =6,则溶液中
=6,则溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与化工生产相关描述不合理的是
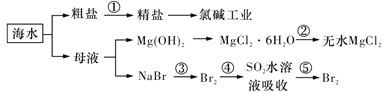
A.在合成氨工业中,低温、高压有利于提高合成氨平衡产率
B.在上图海水的综合利用中![]() 均为氧化还原反应
均为氧化还原反应
C.硫酸工业的基本流程:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
D.可以采用如下方法制备硅:二氧化硅和适量的炭粉混合,高温反应得到粗硅,利用粗硅和氯气反应,其产物在高温下被氢气还原,从而得到较纯的硅
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中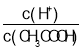 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com