
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用相应的化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中用序号标出的10种元素中,化学性质最不活泼的元素的原子结构示意图是___。
(2)③的单质的电子式为___,结构式为___。
(3)④、⑥、⑧的原子半径由小到大的顺序为___(用元素符号作答)。
(4)金属性最强的是___,非金属性最强的是___,②、③、⑨的最高价氧化物的水化物的酸性由弱到强的顺序是___(用化学式作答)。
(5)由表中两种元素的原子按1:1组成的共价化合物M,M为常见液态化合物,其稀液易被催化分解,请写出M的电子式___,M的结构式___。
(6)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为以正四面体向空间伸展,请写出N及其两种同素异形体的名称___、___、___。
(7)写出⑦元素的最高价氧化物对应水化物分别与元素⑥、⑧的最高价氧化物对应水化物的水溶液反应的离子方程式___、___。
(8)⑥与⑦金属性较强的是___(填元素符号),下列表述中能证明这一事实的是___。
a.⑥的单质和⑦的单质熔沸点不同
b.⑥的最高价氧化物水化物的碱性比⑦的最高价氧化物水化物的碱性强
c.⑦最外层的电子数比⑥多
d.⑦的单质与稀盐酸反应比⑥的缓和一些
(9)①和④形成的气态氢化物与①和⑧形成的气态氢化物相比较,___稳定性强;___沸点高(填化学式),理由是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】五氧化二碘(I2O5)可用作氧化剂,除去空气中的一氧化碳,易溶于水形成碘酸,不溶于无水乙醇、乙醚、氯仿和二硫化碳。用下列装置制备五氧化二碘(加热装置及夹持装置省略)。

制备五氧化二碘的步骤如下:
步骤1:I2与KClO3按一定比例加入反应器M中,用硝酸调节pH=1~2,温度控制在80~90℃,搅拌反应1h,使反应完全。
步骤2:然后冷却至室温,析出碘酸氢钾晶体。将过滤得到的晶体加水、加热溶解,并用足量氢氧化钾溶液中和至溶液pH为10。再冷却结晶,过滤得到的晶体于118℃干燥3h,得到碘酸钾产品。
步骤3:将步骤2制得的碘酸钾酸化后得碘酸(HIO3),再将碘酸在干燥空气气流中加热到200℃失水得到五氧化二碘。
(1)五氧化二碘可除去空气中的一氧化碳,反应生成碘单质,该反应中氧化剂与还原剂的物质的量之比为___。
(2)仪器M的名称是___。
(3)步骤1中除了生成碘酸氢钾[KH(IO3)2]外,同时还生成氯化钾和氯气,若n(KCl):n(C12)=5:3,写出该反应的化学方程式:___,该反应中的氧化剂是___(填化学式)。
(4)反扣的漏斗N除了可以防止倒吸,还有一个作用是____,NaOH溶液的作用是___。
(5)步骤2中的主要反应为KH(IO3)2+KOH===2KIO3+H2O,称取0.550g碘酸钾产品(假设杂质不参与反应),将产品放入烧杯中,加蒸馏水溶解,并加入足量酸化的KI溶液,配制成100mL溶液,取10.00mL配制的溶液于锥形瓶中并加入指示剂,然后用0.1mol·L-1 Na2S2O3标准溶液滴定至终点,三次实验平均消耗标准溶液的体积为15.00mL。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
①该滴定选择的指示剂是_____。
②该碘酸钾产品中碘酸钾的质量分数是____%(保留三位有效数字)。
③若装Na2S2O3标准溶液的滴定管没有用Na2S2O3标准溶液润洗,则所测得产品的质量分数___(填“偏高”或“偏低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是___,E2D2的电子式为___。
(2)AFD的结构式为___,BD2的电子式为___。
(3)EDA的电子式为___,AF的电子式为___。
(4)B元素形成的化合物种类繁多的原因可能是(填序号)___。
①碳原子之间成键方式多样化,碳碳之间可以单键、双键或者叁键
②同分异构现象的普遍存在
③碳碳之间可以通过共价键彼此结合成链状或者环状
(5)元素D、E、F形成的简单离子的半径由大到小为__(用离子符号表示)。
(6)用电子式表示E与F形成化合物的过程___。
(7)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质属于同分异构体是___;属于同素异形体是___;属于同位素是___;属于同一种物质是___。(写序号)
①红磷与白磷 ②12C与14C ③干冰与二氧化碳 ④CH4与CH3CH3 ⑤S2与S8 ⑥235U与238U ⑦![]() 与
与![]() ⑧乙醇(
⑧乙醇( )与二甲醚(
)与二甲醚(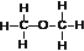 ) ⑨
) ⑨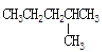 和
和![]() ⑩氰酸铵(NH4CNO)与尿素[CO(NH2)2]
⑩氰酸铵(NH4CNO)与尿素[CO(NH2)2]
查看答案和解析>>
科目: 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是构成物质世界最重要的元素之一,能形成众多的化合物。
![]() 已知
已知![]() 碳完全燃烧可放出3148kJ热量,
碳完全燃烧可放出3148kJ热量,![]() 液态水汽化时要吸收44kJ热量。
液态水汽化时要吸收44kJ热量。
![]()
![]()
![]()
![]()
请写出制备水煤气的热化学方程式________。
![]() 恒容密闭容器中发生
恒容密闭容器中发生![]() 反应,当通入不同量的
反应,当通入不同量的![]() 和
和![]() 充分反应后得到如下实验数据:
充分反应后得到如下实验数据:
实验组 | 温度
| 起始量
| 平衡量
| 达到平衡所需的时间 | ||
|
|
|
| |||
1 | 650 | 2 |
|
| 2 | 4 |
2 | 650 |
|
|
|
| 5 |
![]() 由实验组1数据可知,达到平衡时
由实验组1数据可知,达到平衡时![]() ________mol/(Lmin)。
________mol/(Lmin)。
![]() 由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________。
由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________。
![]() 若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________。
若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________。![]() 填编号
填编号![]()
a.容器中压强不变 b.1molH-H键断裂,同时断裂2molO-H键
c.c(H2O)=c(CO) d.v(H2O)=v(H2) e..容器体积不变
![]() 取
取![]() 草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
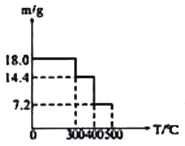
350℃时,固体的成分是________。
②400℃时,样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,也能使灼热的CuO出现红色,则400℃时样品发生反应的化学方程式为________。
③取350℃时的上述样品![]() 难溶于水
难溶于水![]() ,置入0.12mol/L、
,置入0.12mol/L、![]() 的酸性
的酸性![]() 溶液中,二者恰好反应,写出该反应的离子方程式________。
溶液中,二者恰好反应,写出该反应的离子方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( )
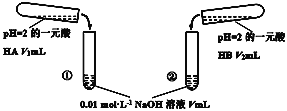
A.因为两种酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,则说明HA为强酸,HB为弱酸
C.若实验①中,V=V1,则混合液中c(Na+)=c(A-)
D.实验②的混合溶液,可能有pH<7
查看答案和解析>>
科目: 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N≡N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1,逆反应速率v(NH3)=0.4 mol·(L·min)-1
A.全部B.②③④⑤⑥⑦
C.②③④⑤⑦D.③④⑤⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】以下说法不正确的是( )
A.C60与金刚石互为同素异形体
B.氢键属于化学键
C.金属元素和非金属元素形成的化合物在熔融状态下一定能导电
D.“NH4Cl”的意义是指氯化铵晶体由NH4+和Cl-构成,阴、阳离子个数比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验,电解一段时间后,各部分装置及对应的现象如下:

对应现象 | (1)中黑色固体变红 | (2)电极a附近溶液出现浑浊 | (3)中溶液出现浑浊 | (4)中溶液红色褪去 |
下列对实验现象解释不正确的是( )
A.(1)中:CuO+H2![]() Cu+H2O
Cu+H2O
B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓
C.(3)中:Cl2+S2-=S↓+2Cl-
D.(4)中:Cl2+H2O![]() HCl + HClO
HCl + HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com