
科目: 来源: 题型:
【题目】下列说法中,有错误的是( )
A.Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应
B.在相同温度下,NaHCO3的溶解度比Na2CO3小
C.Na2CO3很稳定,而NaHCO3受热时容易分解
D.将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物G是一种可用于治疗肿瘤的药物,实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)B的结构简式为______________; C的化学名称是______________。
(2)③的反应试剂和反应条件分别是___________________,该反应的类型是__________。
(3)⑤的反应方程式为____________________。
(4)G的分子式为_____________________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有__________种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线(其他试剂任选)。 ___________________
)制备4-甲氧基乙酰苯胺的合成路线(其他试剂任选)。 ___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸亚铁可用于制备补血剂。某研究小组制备了FeCO3,并对FeCO3的性质和应用进行了探究。
已知:①FeCO3是白色固体,难溶于水
②Fe2++6SCN-![]() Fe(SCN)64-(无色)
Fe(SCN)64-(无色)
Ⅰ.FeCO3的制取(夹持装置略)
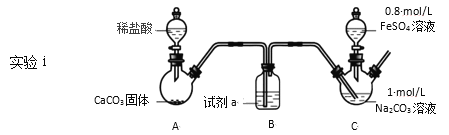
装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a是__。
(2)向Na2CO3溶液通入CO2的目的是__。
(3)C装置中制取FeCO3的离子方程式为__。
(4)有同学认为C中出现白色沉淀之后应继续通CO2,你认为是否合理并说明理由__。
Ⅱ.FeCO3的性质探究
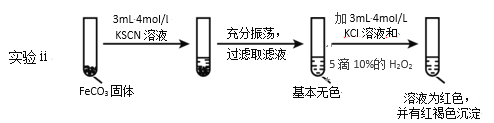
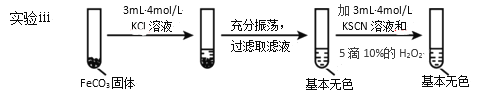
(5)对比实验ⅱ和ⅲ,得出的实验结论是__。
(6)依据实验ⅱ的现象,写出加入10%H2O2溶液的离子方程式__。
Ⅲ.FeCO3的应用
(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,此反应的离子方程式为__。该实验小组用KMnO4测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因是__(不考虑操作不当引起的误差)。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目: 来源: 题型:
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为______。
(2)Na、O、S简单离子半径由大到小的顺序为___________(用简单离子符号表示离子半径)。
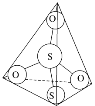
(3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为________。
(4)Na3[Ag(S2O3)2]中存在的作用力有_____________。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为____________________;与SO3相比,____________的键角更大,原因是________________________________。

(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为____________________,已知该晶体的密度为ρg/cm3,则该晶胞的体积为_________ cm3(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)元素Z位于周期表中的第_________周期,_________族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________;
(4)Y的最高价氧化物的化学式为________________;
(5)W和Y形成的一种二元化合物具有色温效应,相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式:_________、_________、_________。
(2)写出含B元素质量分数最高的化合物的电子式:_____________。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式:______________________。
(4)用电子式表示化合物C2B的形成过程:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com