
科目: 来源: 题型:
【题目】将10 g Fe2O3、SiO2、Al2O3的混合物加入足量的100 mL x mol/L稀硫酸中,过滤,然后加入10 mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液的体积关系如图所示。下列叙述错误的是
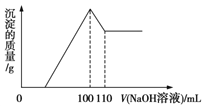
A.滤出的物质为SiO2
B.可求出x的值
C.可求出Al2O3的质量分数
D.可求出Fe2O3的质量分数
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,氧化剂与还原剂为同一种物质的是
A.SO2+2H2S=3S↓+H2B.2NO2+2NaOH=NaNO2+NaNO3+H2O
C.Zn+2HCl=ZnCl2+H2↑D.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
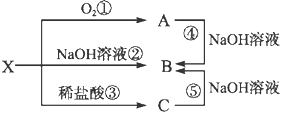
(1)写出以下反应的离子方程式:
②___________________________;
④___________________________。
(2)确定化学式B_______ X_______
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
A.充分反应后,X的转化率和Y的转化率不相等,前者大于后者
B.当反应达到平衡状态时,W与M的物质的量浓度之比一定为2:1
C.当混合气体的密度不再改变,表明该反应已达平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目: 来源: 题型:
【题目】在日常生活和生产过程中化学有着重要的应用,下列有关说法正确的是
A.洪涝、地震灾区灾后可用石灰消毒,是利用石灰可使蛋白质发生变性的性质
B.食品添加剂对人体均有益,可随意使用
C.生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品
D.![]() 是指大气中直径小于或等于
是指大气中直径小于或等于![]() 微米的颗粒物,也称为可入肺颗粒物,分散在空气中可能形成胶体
微米的颗粒物,也称为可入肺颗粒物,分散在空气中可能形成胶体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列工业生产所涉及的化学用语表达不正确是
A.工业上制取氯气:MnO2+4HCl![]() Cl2↑+MnCl2+H2O
Cl2↑+MnCl2+H2O
B.工业上合成氨:N2+3H2![]() 2NH3
2NH3
C.工业上制取粗硅:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.工业上生产漂白粉:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.10mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)___。
(2)判断滴定终点的现象是___。
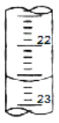
(3)如图是某次滴定时滴定管中的液面,其读数为__mL。
(4)根据下列数据:请计算待测盐酸溶液的物质的量浓度c(HCl)=___mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)若测定结果偏高,其原因可能是___。
A.在配制0.10mol/LNaOH标准溶液定容时,俯视容量瓶刻度线
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡
(6)某同学用0.10mol/LNaOH标准溶液分别滴定20.00mL0.10mol/L的HCl溶液和20.00mL0.10mol/L的CH3COOH溶液,得到如图所示的两条滴定曲线:
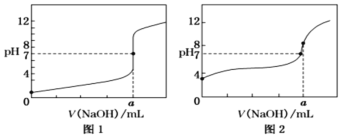
①用0.10mol/L的NaOH标准溶液滴定20.00mL0.10mol/L的CH3COOH溶液的曲线是___(填“图1”或“图2”)。
②a=___mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka___(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___(填序号)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___(填序号)。
a.![]() b.
b.![]()
c. ![]() d.
d.![]()
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液c(H2CO3)___c(CO32-)(填“>、<或=”),原因是___。
(5)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中:
①![]() =___(填“精确数值”,下同)。
=___(填“精确数值”,下同)。
②c(CH3COO-)-c(Na+)=___mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应中,不属于离子反应的是( )
A.在水溶液中:CH3COOH+NH3·H2O===CH3COONH4+H2O
B.在水溶液中:Cu(OH)2+2HNO3===Cu(NO3)2+2H2O
C.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D.在水溶液中:CaSO4+Na2CO3===CaCO3↓+Na2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】高温下用H2还原CuCl制备活性铜,反应原理如下:
2Cu(s)+Cl2(g) ![]() 2CuCl(s) ΔH1=-36 kJ·mol-1①
2CuCl(s) ΔH1=-36 kJ·mol-1①
H2(g)+2CuCl(s) ![]() 2Cu(s)+2HCl(g) ΔH2②
2Cu(s)+2HCl(g) ΔH2②
有关物质的键能数据如下表:
物质 | H2 | Cl2 | HCl |
键能/kJ·mol-1 | 436 | 243 | 432 |
(1)ΔH2=________kJ·mol-1。
(2)经测定反应②制备活性铜的反应趋势大,原因是__________。
(3)在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),在图中画出Cl2浓度的变化趋势线。________________________

(4)白色不溶于水的CuCl可以由电解法制得,如图所示:

①装置中用的交换膜为________。
A.阳离子交换膜 B.阴离子交换膜
C.质子交换膜 D.氢氧根离子交换膜
②阳极的电极反应式为______________________________________________。
(5)已知CuCl可溶解于稀硝酸,写出该反应的化学方程式:
________________________________________________________________________。
(6)根据已学知识写出制取CuCl的一种方法,用化学方程式表示:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com