
科目: 来源: 题型:
【题目】中学常见的A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
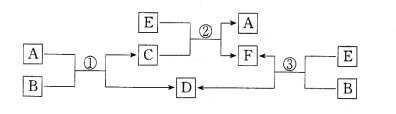
(1)若B是水,C是一种有磁性的黑色化合物,则反应①的化学方程式为_______。
(2)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环,反应①的离子方程式是______________________________________。在反应③中,若生成1 mo1 D,则转移电子数目为______________。
(3)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为_________________,其中A的化学式是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述正确的是( )
4NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.反应达到平衡时,反应物的转化率一定小于100%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒沙特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.实验室中常用排饱和食盐水的方法收集Cl2
C.工业合成氨时选择高温能极大加快反应速率
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物Y具有保肝、抗炎、增强免疫等功效,可由X制得。下列有关化合物X、Y的说法正确的是

A.一定条件下X可发生氧化、取代、消去反应
B.1 mol Y最多能与4mol NaOH反应
C.X与足量H2反应后,每个产物分子中含有8个手性碳原子
D.等物质的量的X、Y分别与足量Br2反应,最多消耗Br2的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。0. 25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程式中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=267 kJ·mol-1
N2(g)+H2O(g) ΔH=267 kJ·mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=534 kJ·mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.常温下,向稀醋酸溶液中缓慢通入NH3,溶液中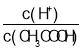 的值增大
的值增大
B.298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
C.标准状况下,将22.4 L Cl2通入足量NaOH溶液中,反应转移的电子数为2×6.02×1023
D.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:
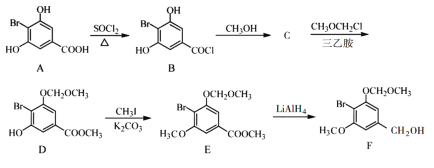
(1)A中含氧官能团的名称为_________。
(2)A→B的反应类型为________。
(3)写出B→C的化学反应方程式:________
(4)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(5)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(6)已知: (R表示烃基,R'和R"表示烃基或氢)
(R表示烃基,R'和R"表示烃基或氢)
写出以![]() 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备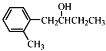 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)__________。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,某无色溶液用激光笔照射无丁达尔现象,加入FeCl3后溶液显色.下列各组微粒在此溶液可以大量共存的是
A.Na+、K+、Fe2+、Cl-
B.K+、Fe2+、NO3-、Fe(OH)3(胶体)
C.Cl-、SCN-、NH4+、葡萄糖分子
D.OH-、Na+、苯酚、Br-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据实验现象得出的结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 废FeCl3蚀刻液中加入少量铁粉,振荡 | 得到澄清溶液 | 蚀刻液中一定不含Cu2+ |
B | 将Fe(NO3)2样品溶于H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
C | 向两份蛋白质溶液中分别滴加饱和硫酸钠溶液和硫酸铜溶液 | 均有固体析出 | 蛋白质均发生变性 |
D | 葡萄糖溶液与新制Cu(OH)2混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】含+6价铬的废水毒性强,对环境污染严重,工业上常利用化学原理把+6价铬转化为不溶性Cr(OH)3除去。
Ⅰ、SO2还原法:化工厂常用SO2处理含铬废水,其工艺流程如下图所示:
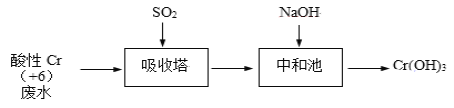
已知:Cr2O72- + H2O ![]() 2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
(1)其他条件不变,研究吸收塔中pH对反应的影响。
pH | 2 | 4 | 6 |
Cr(+6)最大去除率 | 99.99%达排放标准 | 99.95%达排放标准 | 99.5%未达排放标准 |
时间 | 30 min | 35 min | 45 min |
①由上述数据获得的结论有_________。
②实际工业生产控制pH = ____左右。
③下列说法不合理的是_____。
a.该酸性含铬废水中一定含有CrO42-,pH越大其含量越高
b.其他条件不变,增大压强,吸收塔中反应的K增大,有利于除去Cr(+6)
c.理论上看,SO32-、Fe2+等也可以用于除去Cr(+6)
(2)其他条件不变,研究温度对Cr(+6)去除率的影响(如图所示)。
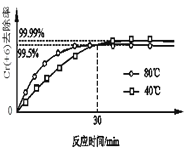
已知:30min前相同时间内,80℃的Cr(+6)去除率比40℃高,是因为30min前反应正向进行,温度高反应速率快反应物的转化率增大;试解释30min后80℃的Cr(+6)去除率低的原因:________。
Ⅱ、电解法处理:
工业上处理含Cr2O72-离子的酸性废水,采用往工业废水中加入适量的食盐,再用Fe为电极进行电解,将Cr2O72—离子还原为可溶性三价铬离子,再调pH使三价铬离子变为不溶性氢氧化物除去。
(1)加入食盐的目的是 _______;
(2)电解时阳极反应式为 _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com