
科目: 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是
A.图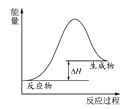 可表示石灰石分解反应的能量变化
可表示石灰石分解反应的能量变化
B.图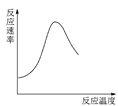 可表示酶催化反应的反应速率随反应温度的变化
可表示酶催化反应的反应速率随反应温度的变化
C.图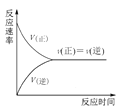 可表示在一定条件的可逆反应中,正反应速率和逆反应速率随时间的变化
可表示在一定条件的可逆反应中,正反应速率和逆反应速率随时间的变化
D.图 可表示向H2SO4溶液中滴加Ba(OH)2溶液,溶液的导电性随碱溶液体积的变化
可表示向H2SO4溶液中滴加Ba(OH)2溶液,溶液的导电性随碱溶液体积的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
①SO2、CS2、HI都是直线形的分子 ②价电子排布式为ns2的原子属于ⅠA或ⅡA族元素 ③Ge是ⅣA族的一种元素,其核外电子排布式为:[Ar]4s24p2,属于P区元素 ④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子⑤化合物NH4Cl和CuSO4·5H2O都存在配位键 ⑥AgCl是一种白色的沉淀,不溶于硝酸、浓硫酸、烧碱溶液,却能溶于氨水中 ⑦已知熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,则从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体 ⑧氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式为![]()
A.①③B.②④C.⑤⑥D.⑤⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】以绿矾(主要成分FeSO4·7H2O,部分Fe2+已被氧化为Fe3+)为原料,生产铁红(Fe2O3)的工艺流程如下:
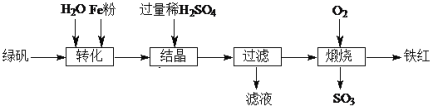
(1)“转化”过程中,加入Fe粉时发生反应的离子方程式为____;为提高该反应速率可采取的措施有:____、____。
(2)“结晶”时,控制温度在75℃左右进行(相关物质的溶解度见下图),从溶液中析出的晶体是____(填化学式)。
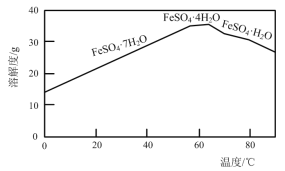
(3)“滤液”的主要成分为FeSO4、____(填化学式)。利用该滤液将工业废水中的Cr2O72—还原为Cr3+,然后投加石灰乳,使Cr3+转化为Cr(OH)3,理论上完全反应消耗的n(FeSO4)∶n(Cr2O72—) =____。
(4)“煅烧”时生成铁红的化学方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】1840年,俄国化学家盖斯(Hess)指出:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这就是著名的“盖斯定律”。现已知在101KPa下CH4、H2、C(固)的燃烧热分别为890.83kJ·mol-1、285.83kJ·mol-1和393.51 kJ·mol-1,则反应C(s)+2H2(g)=CH4(g)的反应热△H=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
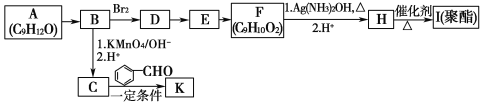
已知以下信息:
①A的苯环上只有一个支链,支链上只有两种不同化学环境的氢原子,且A能发生酯化反应;
②![]()
![]()
![]() +CO2;
+CO2;
③RCOCH3+R′CHO![]() RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。
回答下列问题:
(1)A生成B的反应类型为________,由E生成F的反应方程式为__________________
(2)K中含有两个六元环,则K的结构简式为_____________________。
(3)由F生成H的过程中第1步的化学方程式为_____________________。
(4)H有多种同分异构体,满足下列条件的有_________种,写出其中任意一种的结构简式:________。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③具有4组核磁共振氢谱峰
(5)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。__________________________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益.其分子结构如图所示,下列说法不正确的是( )

A. 油酸的分子式为C18H34O2
B. 油酸可与氢氧化钠溶液发生中和反应
C. 1mol油酸可与2molH2发生加成反应
D. 1mol甘油可与3mol油酸发生酯化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】一般硫粉含有S(单斜)和S(正交)两种同素异形体。已知常温下:
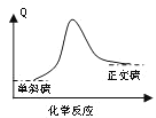
①S(单斜)+O2(g) =SO2(g) ΔH=-297.16 kJ/mol
②S(正交)+O2(g) = SO2(g) ΔH=-296.83 kJ/mol
下列说法错误的是( )
A.S(g)+O2(g)=SO2(g) ΔH=-Q3 kJ/mol Q3> 297.16
B.单斜硫转变为正交硫的能量变化可用如图表示
C.常温下单斜硫比正交硫稳定
D.单斜硫转化为正交硫的反应是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A. 淀粉![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B. 纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C. 油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D. 蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一容积为2 L的密闭容器内加入0.2 mol 的N2和0.6 mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
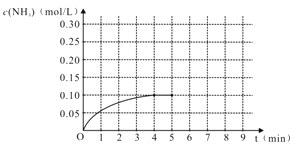
(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为_________________。
(2)该反应的化学平衡常数表达式K=___________________。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡_________________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物W(分子式C3H6O3)能与NaHCO3反应产生CO2,也能与Na反应生成H2,且1 mol W与足量Na反应能生成1 mol H2,分子中核磁共振氢谱为四组峰,峰面积之比为3∶1∶1∶1。
(1)W的结构简式是______________。
(2)W在不同条件下可脱水形成不同物质。若两分子W反应形成环酯,写出反应方程式:_________________。
(3)W的某种同分异构体具有下列性质:
能发生的银镜反应;1 mol该物质能跟金属钠反应产生1 mol H2。
则该同分异构体的结构简式为____________(已知同一个碳原子上不能连接2个羟基)。
(4)W的工业合成路线如图所示:
乙烯![]() A
A![]() B
B![]() C
C![]() D
D![]()
![]() W
W
已知:Ⅰ.A、B、C、D与W分子中含有相同碳原子数;
Ⅱ.RCH2COOH![]()
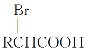
①写出A的名称:__________。
②B与新制Cu(OH)2悬浊液反应的化学方程式是: _______________。
③D与NaOH水溶液反应的化学方程式为:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com