
科目: 来源: 题型:
【题目】一定温度下,向容积为10L的密闭容器内通入![]()
![]() 和
和![]()
![]() ,经2s后达到平衡状态,平衡时
,经2s后达到平衡状态,平衡时![]() 为
为![]() 。
。
(1)达到平衡时氨气的物质的量浓度为:________。
(2)用![]() 的浓度变化表示2s内的平均速率
的浓度变化表示2s内的平均速率![]() ________。
________。
(3)达到平衡时氮气的转化率是________。
(4)平衡时混合气体中氨的体积分数(和物质的量分数相同)是________。
(5)平衡时氮气、氢气、氨气的分子数之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法错误的是 ( )
A. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
B. 工业生产玻璃、水泥,均需要用石灰石为原料
C. 将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用
D. 纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气具有还原性,能够被氧化铜氧化,用如图中的装置可以实现该反应。已知氨可以与灼热的氧化铜反应得到氮气和金属铜。回答下列问题:
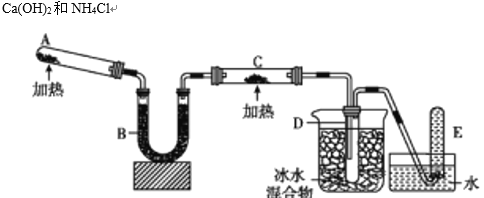
(1)写出A中反应方程式:________________。
(2)写出氨气与灼热氧化铜的反应方程式:________________。
(3)B中加入的干燥剂是________(填序号)
①浓硫酸 ②无水氯化钙 ③碱石灰
(4)能证明氨与氧化铜反应的现象是C中________。
(5)D中有无色液体生成。检验D中无色液体的成分时会用到下列哪一种药品________(填序号)
A.![]() B.
B.![]() C.无水硫酸铜
C.无水硫酸铜
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
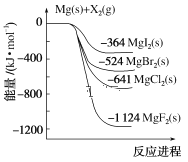
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】钛广泛应用于航天、军事、化工、医疗等领域。钛在高温下易和氧、氮、碳等元素化合,提炼纯钛条件苛刻。从高钛渣![]() 主要为
主要为![]() 提炼海绵钛流程如下:
提炼海绵钛流程如下:
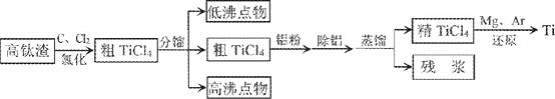
氯化后的粗![]() 中含有
中含有![]() 、
、![]() 、
、![]() 、
、![]() 等杂质,相关物质的沸点如下表:
等杂质,相关物质的沸点如下表:
化合物 |
|
|
|
|
|
沸点 | 136 | 310 |
| 180 | 138 |
回答下列问题:
![]() 高钛渣经过破碎、磁选、磨粉后送氯化车间,磨粉的目的是________。
高钛渣经过破碎、磁选、磨粉后送氯化车间,磨粉的目的是________。
![]() “分馏
“分馏![]() ,原因是________。加入铝粉使
,原因是________。加入铝粉使![]() 转化为
转化为![]() 便于除去,写出铝粉与
便于除去,写出铝粉与![]() 反应的化学方程式:________。
反应的化学方程式:________。
![]() “除铝”的方法是用水湿润的活性炭加入到粗
“除铝”的方法是用水湿润的活性炭加入到粗![]() ,使
,使![]() 转化为________而除去。
转化为________而除去。
![]() “还原”需要在Ar的气氛中进行,原因是________。副产物经电解生成________可循环使用。
“还原”需要在Ar的气氛中进行,原因是________。副产物经电解生成________可循环使用。
![]() 制备钛的一种新型方法是:将
制备钛的一种新型方法是:将![]() 粉末浇注成形,烧结后作阴极,以石墨为阳极,
粉末浇注成形,烧结后作阴极,以石墨为阳极,![]() 为熔盐进行电解
为熔盐进行电解![]() 熔盐不参与电极反应,起溶解和传导
熔盐不参与电极反应,起溶解和传导![]() 的作用
的作用![]() 。
。
![]() 阳极生成的气体除
阳极生成的气体除![]() 外,还有________
外,还有________![]() 填化学式
填化学式![]() 。
。
![]() 阴极的电极反应式为________。
阴极的电极反应式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增加。A、B、C、D均是由这些元素组成的二元化合物,甲是Y的固体单质,常温下0.05mol/L乙溶液的pH为1。A是无色气体,是主要的大气污染物之一,上述物质的转化关系如图所示。下列说法错误的是( )
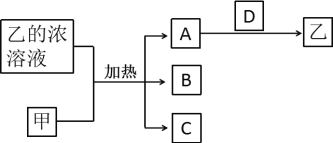
A.原子半径:X<Z<W
B.D中存在极性键和非极性键
C.最高价含氧酸的酸性:W>Y
D.化合物YZW中键角为120°
查看答案和解析>>
科目: 来源: 题型:
【题目】向盛有5 mL 0.01 mol/L的硫氰化钾溶液的小烧杯中,加入5 mL0.01 mol/L的FeCl3溶液,混合液立即__________。写出上述反应的离子方程式_____________。向以上溶液中再加0.1 mol/L NaOH溶液至过量,其现象是__________,写出发生上述现象的反应离子方程式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二镍![]() 主要用作陶瓷、玻璃等的着色颜料,也经常用于制造镍电池。查阅资料知:
主要用作陶瓷、玻璃等的着色颜料,也经常用于制造镍电池。查阅资料知:
Ⅰ![]() 工业上利用含镍废料
工业上利用含镍废料![]() 镍、铁、钙、镁合金为主
镍、铁、钙、镁合金为主![]() 制取草酸镍
制取草酸镍![]() ,再高温煅烧草酸镍制取三氧化二镍。
,再高温煅烧草酸镍制取三氧化二镍。
Ⅱ![]() 草酸的钙、镁、镍盐均难溶于水。
草酸的钙、镁、镍盐均难溶于水。
Ⅲ![]() 、
、![]() .
.
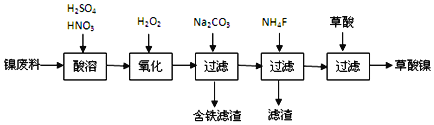
根据下列工艺流程示意图回答问题。
![]() 加入
加入![]() 发生的主要反应的离子方程式为______,加入
发生的主要反应的离子方程式为______,加入![]() 溶液调pH至
溶液调pH至![]() ,其目的为______,当加入过量
,其目的为______,当加入过量![]() 后,所得滤液中
后,所得滤液中![]() ______。
______。
![]() 草酸镍
草酸镍![]() 在热空气中干燥脱水后在高温下煅烧三小时,制得
在热空气中干燥脱水后在高温下煅烧三小时,制得![]() ,同时获得混合气体。草酸镍受热分解的化学方程式为______。
,同时获得混合气体。草酸镍受热分解的化学方程式为______。
![]() 工业上还可用电解法制取
工业上还可用电解法制取![]() 用NaOH溶液调节
用NaOH溶液调节![]() 溶液的pH至
溶液的pH至![]() ,加入适量
,加入适量![]() 后采用惰性电极电解。电解过程中产生的
后采用惰性电极电解。电解过程中产生的![]() 有
有![]() 在弱碱性条件下生成
在弱碱性条件下生成![]() ,再把二价镍氧化为三价镍。
,再把二价镍氧化为三价镍。![]() 氧化
氧化![]() 生成
生成![]() 的离子方程式为______。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为______。
的离子方程式为______。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为______。
![]() 镉镍可充电电池在现代生活中有广泛的应用,其充、放电反应过程按下式进行:
镉镍可充电电池在现代生活中有广泛的应用,其充、放电反应过程按下式进行:![]()
![]()
![]() ,写出该电池充电时阴极的电极反应式______。
,写出该电池充电时阴极的电极反应式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验原理、装置、操作或结论的描述正确的是( )
A.图反应一段时间后试管中液面会下降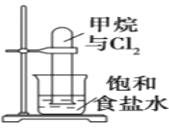
B.图装置可用于分离乙醇和乙酸乙酯的混合液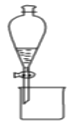
C.图装置可用于实验室制乙炔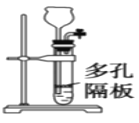
D.图教材重结晶法提纯苯甲酸的实验中,主要步骤依次为:加热溶解→趁热过滤→冷却结晶→过滤
查看答案和解析>>
科目: 来源: 题型:
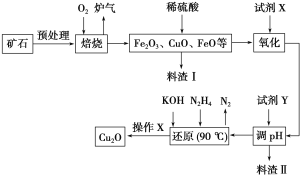
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com