
科目: 来源: 题型:
【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:_____根据测量结果,甲推测等浓度的NaOH溶液、CH3COOH溶液中,由水电离出的H+浓度c(H+)NaOH____c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)。然后分别加水稀释到100 mL后,再次测量,稀释后的HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人体血液中,HCO3-的水解程度____电离程度(填“>”、“<”或“=”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序___________
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=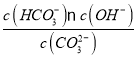 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=______mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中再加入少量AgCl固体,则c(Cl-)_____(填“增大”或“减小”或“span>不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 铝粉投入NaOH溶液中:2Al+2OH-===2AlO2-+H2↑
B. Na与CuSO4溶液反应:Cu2++2Na===2Na++Cu
C. 向AlCl3溶液中加入足量的氨水:Al3++3OH-===Al(OH)3↓
D. Ba(OH)2溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,可逆反应![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2,同时生成2nmol![]()
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成nmolO2,同时生成2nmolNO
⑤混合气体的颜色不再改变
⑥用![]() 、NO、
、NO、![]() 的物质的量浓度变化表示的反应速率的比为2:2:1
的物质的量浓度变化表示的反应速率的比为2:2:1
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=![]() +
+![]() + H2O
+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E五种均可溶于水的固体物质,是由以下提供的几种离子组成![]() 每种离子只能用一次
每种离子只能用一次![]() :
:
阳离子 |
|
阴离子 |
|
现分别进行如下实验:
![]() 将D与E的溶液混合加热,产生有刺激性气味的气体
将D与E的溶液混合加热,产生有刺激性气味的气体
![]() 将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解
将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解
![]() 在常温下用pH试纸测定溶液A的
在常温下用pH试纸测定溶液A的![]()
下列说法不正确的是![]()
A.物质E的化学式为![]() B.物质D中一定含有
B.物质D中一定含有![]()
C.难以确定物质A的组成D.物质C的化学式是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
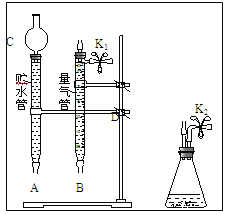
①写出本实验的化学方程式,并标出电子转方向和数目:__________________________.
②设计实验方案:在_________________下,测定________________________________.
③在答卷的图中将A、B、C、D、几处用橡胶管以正确方式连接起来,以测定反应所产生气体的体积(三个容器中的液体和水都已画出)_______________.
④测定前,为避免NO被氧化为NO2,要用CO2排出锥形瓶和橡胶管中的空气:在锥形瓶中加入铜片后松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是____________,则空气已排尽.
(2)注入稀硝酸后,在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:____________
实验 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 | 时间 | 收集气体 |
① | a | V | 25 | t1 | V1 |
② | V | ||||
③ | V |
查看答案和解析>>
科目: 来源: 题型:
【题目】如今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)
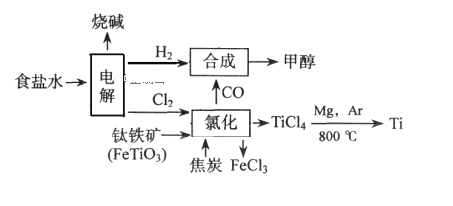
下列叙述正确的是( )
A.该流程中只有“电解”、“氯化”涉及氧化还原反应
B.“合成”反应中氧化剂与还原剂的物质的量之比为1:1
C.“氯化”时反应方程式为7Cl2+2FeTiO3+6C=2FeCl3+2TiCl4+6CO(条件省略)
D.上述流程中“Mg,Ar"可用“Mg,CO2”代替
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3产率的有__________。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③,5分钟时达到化学平衡,平衡后测得H2的体积分数为0.1。则5分钟v(H2O)=_______________,CO的转化率α(CO)=___________。
(4)将合成气以![]() =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
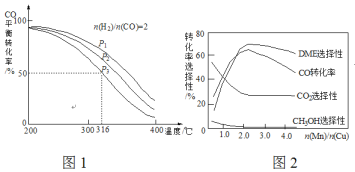
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
A.△H <0 B.P1>P2>P3
C.若在P3和316℃时,起始时![]() =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题。催化剂中![]() 约为___________时最有利于二甲醚的合成。
约为___________时最有利于二甲醚的合成。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A. 增大c(A)、c(B),K增大
B. 降低温度,正反应速率增大
C. 该反应的焓变为负值
D. 该反应的化学方程式为2E(g)+F(g)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】某酸性工业废水中含有![]() ,光照下,草酸
,光照下,草酸![]() 能将其中的
能将其中的![]() 转化为
转化为![]() 某课题组研究发现,少量铁明矾
某课题组研究发现,少量铁明矾![]() 即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,
即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,
探究如下:在![]() 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,具体数据如表:
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,具体数据如表:
实验编号 | 初始pH | 废水样品体积 | 草酸溶液体积 | 蒸馏水体积 |
| 4 | 60 | 10 | 30 |
| 5 | 60 | 10 | 30 |
| 5 | 60 | 15 | 25 |
测得实验![]() 和
和![]() 溶液中的
溶液中的![]() 随时间变化关系如图所示.
随时间变化关系如图所示.
(1)实验![]() 和
和![]() 的结果表明 ______ .
的结果表明 ______ .
(2)根据实验![]() 和
和![]() ,画出实验
,画出实验![]() 中
中![]() 随时间变化的趋势图._____________
随时间变化的趋势图._____________
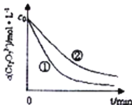
(3)该课题组对铁明矾![]() 中起催化作用的成分提出如下假设,请你完成假设二和假设三:
中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:![]() 起催化作用;
起催化作用;
假设二: ______ ;
假设三: ______ ;
![]()
(4)设计实验验证上述假设一,可选用下列物质代替少量铁明矾![]()
的是 ______ ![]()
![]()
![]() ,
,![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com