
科目: 来源: 题型:
【题目】我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)Cu+的核外电子排布式为_________。
(2)新型农药松脂酸铜具有低残留的特点,图是松脂酸铜的结构简式。加“*”碳原子的杂化方式为______。
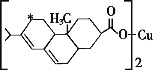
(3)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型为____,比较第一电离能:N__(填“>”或“<”)O。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醇的沸点明显高于乙醛,其主要原因为___________。
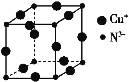
(5)某铜矿石的晶胞结构如图所示,写出其化学式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】LiMn2O4是一种无污染、成本低的锂离子电池电极材料,某研究小组利用柠檬酸配合法制备LiMn2O4。
(1)按一定配比将醋酸锂(CH3COOLi)和醋酸锰[(CH3COO)2Mn]溶液混合后,加入柠檬酸(分子式C6H8O7)溶液中配成混料。用6 mol·L-1氨水调节pH至6.5~9,在75℃~85℃水浴中加热,制得柠檬酸配合物(其中Mn为+2价)。装置如图所示(加热和夹持装置已略去)。
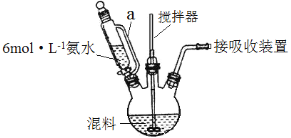
①滴液漏斗中a管的作用是________。
②实验室用14.8 mol·L-1浓氨水配制250 mL 6mol·L-1的氨水需要的仪器有胶头滴管、烧杯、玻璃棒、量筒、________。
③调节pH至6.5~9是为了促进柠檬酸电离。pH不能大于9的原因是______。
④用水浴加热的目的是__________。
(2)将制得的配合物在烘箱中真空干燥得到固态柠檬酸配合物前驱体,研磨后焙烧,得LiMn2O4。
①柠檬酸配合物前驱体应放在_______(填仪器名称)中焙烧。
②焙烧需要在空气中进行的原因是__________。
③焙烧产生的气体是________。
(3)测定产品中锰的含量:准确称取0.1000 g的产品试样,加入足量浓盐酸溶液加热溶解,驱赶溶液中残留的Cl2,配成250 mL溶液。取25.00 mL溶液于锥形瓶中用0.02000 mol·L-1EDTA(Mn2+与EDTA按1:1络合)滴定,消耗EDTA溶液的体积V mL。样品中锰的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨氮是水体中氮的主要形态之一,氨氮含量过高对水中生物会构成安全威胁。
(1)一定条件下,水中的氨氮可以转化为氮气而除去。
已知:2NH4+(aq)+3O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH=a kJ·mol-1
2NO2-(aq)+O2(g)=2NO3-(aq) ΔH=b kJ·mol-1
5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH=c kJ·mol-1
则4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=________kJ·mol-1。
(2)实验室用电解法模拟处理氨氮废水。电解时,不同氯离子浓度对溶液中剩余氨氮浓度的影响如图所示。增大氯离子浓度可使氨氮去除率____(填“增大”、“减小”或“不变”),其原因是阳极生成强氧化性气体,则阳极电极反应为_______。

(3)化学沉淀法是一种处理高浓度氨氮废水的有效方法。通过加入MgCl2和Na2HPO4将NH4+转化为MgNH4PO4·6H2O沉淀除去。25 ℃时,在氨氮初始质量浓度400 mg·L-1、n(Mg)∶n(P)∶n(N)=1∶1∶1的条件下,溶液pH对氨氮去除率及剩余氨氮浓度和总磷浓度的影响如图所示。
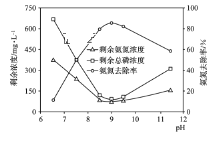
①反应生成MgNH4PO4·6H2O沉淀的离子方程式为______________。
②该实验条件下,控制溶液的适宜pH范围为________;当pH>9时,溶液中总磷浓度随pH增大而增大的主要原因是_________(用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是( )
A. 0.1mol·L-1(NH4)2Fe(SO4)2溶液:c(![]() )>c(
)>c(![]() )>c(H+)>c(Fe2+)
)>c(H+)>c(Fe2+)
B. 将100mL 0.1mol·L-1Na2CO3溶液逐滴滴加到100mL 0.1mol·L-1盐酸中:c(Na+)>c(C1-)>c(![]() )>c(
)>c(![]() )
)
C. pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 0.1mol·L-1NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) +2H2(g) ![]() CH3OH(g) △H =-90.8 kJ·mol-1
CH3OH(g) △H =-90.8 kJ·mol-1
300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
平衡 时 数据 | CH3OH的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | a kJ | bkJ | ckJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法正确的是
A. 2c1>c3 B. ∣a∣+∣b∣=90.8
C. 2p2<p3 D. a1+ a3<1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,水溶液中H+的浓度变化曲线如图所示,下列说法正确的是( )
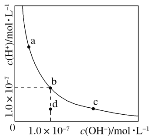
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾是绿色、环保型水处理剂。工业上利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程:
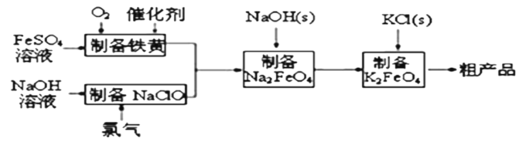
回答下列问题:
(1)已知:常温下,Ksp[Fe(OH)3]=4.0×10—38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=_______________molL﹣1
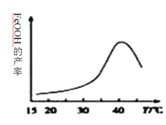
(2)制备铁黄的离子方程式为_______________。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择_________。
(3)①高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
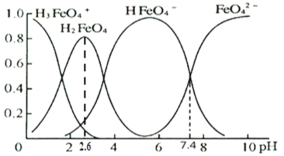
pH=2.6时,溶液中主要含铁形体浓度的大小关系为________。
②已知H3FeO4+电离常数分别为:K1=2.51×10—2,K2=4.16×10—4,K3=5.01×10—8,当pH=4时,溶液中![]() =________。
=________。
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应式为__________;其中可循环使用的物质____________。
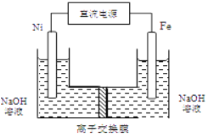
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com