
科目: 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据如图回答下列问题:

(1)写出结构简式:B___,D___。
(2)写出②、④两步反应的化学方程式,并注明反应类型
②__,反应类型__。
④__,反应类型__。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包白色粉末,由Na2SiO3、BaSO4、BaCO3、Na2SO3、NaOH中的一种或几种组成,为了探究它的成分,进行了如下实验:

下列判断错误的是( )
A.生成白色沉淀D的离子方程式为SiO32-+2H+=H2SiO3↓
B.BaSO4一定不存在,NaOH可能存在
C.Na2SiO3、BaSO4、BaCO3、Na2SO3一定存在,NaOH可能存在
D.气体B和气体E均可使澄清的石灰水变浑浊
查看答案和解析>>
科目: 来源: 题型:
【题目】A~D等几种烃分子的球棍模型如图所示,据此回答下列问题。
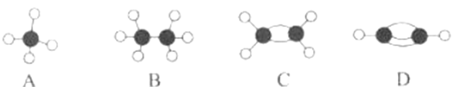
(1)D的分子式为__,A的二氯取代物有__种。
(2)分子中所有原子共平面的是__(填序号)。C可以通过加聚反应生成一种常见的高分子材料,写出该反应的化学方程式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()

A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
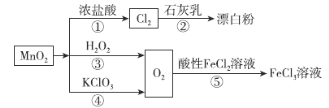
A.反应①中氧化剂与还原剂的物质的量之比为1:4
B.反应①②③④⑤均属于氧化还原反应
C.生成等量的O2,反应③和④转移的电子数之比为1:1
D.反应⑤的离子反应方程式为2Fe2++O2+2H+=2Fe3++2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A单质晶体的晶胞结构如图2所示。B的价电子排布为(n+1)sn(n+1)pn+2,C位于元素周期表的ds区,其基态原子不存在不成对电子。B与C所形成化合物晶体的晶胞如图3所示。
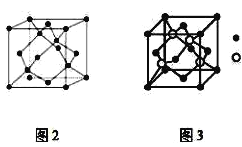
(1)A单质晶体属于__晶体(填晶体类型)。其原子杂化方式为__。
(2)B与C所形成化合物晶体的化学式__。
(3)B与C所形成化合物晶体的密度为ag/cm3,则B原子之间最近距离为__cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中通过酸碱中和滴定实验测定盐酸的浓度。取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用标准的NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.10 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.90 | 20.00 |
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_____________________。
(2)该实验滴定达到终点的标志是__________________________。
(3)根据上述数据,可计算出该盐酸的浓度约为_________。(保留两位有效数字)
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。
A滴定终点读数时俯视读数
B滴定过程中,不小心滴到桌子上几滴
C碱式滴定管尖嘴部分有气泡,滴定后消失
D锥形瓶水洗后未干燥
查看答案和解析>>
科目: 来源: 题型:
【题目】面对世界范围内的能源危机,甲醇作为一种可再生能源,有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:____
(2)对于CO(g)+2H2(g)CH3OH(g) ΔH1=-90 kJ·mol-1,在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时CO的转化率与温度、压强的关系如图所示。
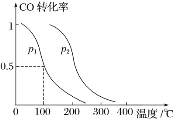
①p1 _______(填“大于”“小于”或“等于”) p2。
②在其他条件不变的情况下,缩小体积使压强增大,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”),平衡常数________(填“增大”“减小”或“不变”)。
(3)已知在温度T时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,判断此时刻υ正________(填“>” 、“=”或“<”)υ逆。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置不能完成对应实验的是( )
A.图甲可以用来制备Fe(OH)3胶体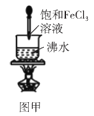
B.图乙可以用来证明酸性强弱顺序:H2SO4>H2CO3>H2SiO3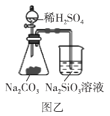
C.图丙可以通过点燃肥皂泡来检验是否有氢气气体生成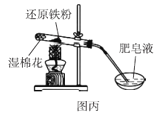
D.图丁可以用陶瓷坩埚加热融化NaOH固体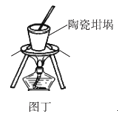
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
①针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
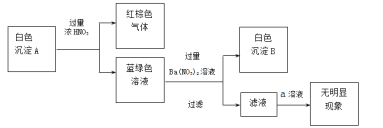
请回答:
Ⅰ.根据白色沉淀B是__(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ.仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__。
Ⅲ.向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__(填化学式)。
根据以上实验,证明A仅为CuSCN。
②进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整: Cu2++ SCN-= CuSCN↓+ (SCN)2__
③结合上述过程以及Fe(SCN)3Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__或__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com