
科目: 来源: 题型:
【题目】已知在25℃时,下列反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g) K1=1×10-30
2NO(g) K1=1×10-30
②2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
③2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法正确的是
A.NO分解反应NO(g)![]()
![]() N2(g)+
N2(g)+![]() O2(g)的平衡常数为1×10-30
O2(g)的平衡常数为1×10-30
B.根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D.温度升高,上述三个反应的平衡常数均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
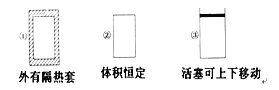
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目: 来源: 题型:
【题目】中国科学家用金属钠和CO2在一定条件下制得了金刚石:
(1)配平上述反应的化学方程式: ___ Na + _____CO2![]() _____Na2CO3 + _____C(金刚石)。若反应过程中有0.15mol CO2反应,则电子转移的数目为:____________。
_____Na2CO3 + _____C(金刚石)。若反应过程中有0.15mol CO2反应,则电子转移的数目为:____________。
(2)CO2的电子式为:_________________,Na原子核外电子有_______个能级。
(3)已知:
常压下 | 钠 | Na2CO3 | 金刚石 | 石墨 |
熔点(℃) | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
若反应在常压、890℃下进行,写出该反应的平衡常数表达式______________________。若3v正(Na)=4v逆(CO2),则________(选填序号)。
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(4)副产物Na2CO3溶于水后溶液呈碱性,请结合平衡移动的原理,用文字描述所得溶液呈碱性的原因:______________________________________________________________________________________。若在10升容器中,反应进行了5min, 金刚石的质量增加了6g,则5min里CO2的平均反应速率 为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20.00mL0.1mol/L的甲胺(CH3NH2)溶液中滴加0.1mol/L 的盐酸,混合溶液的pH与相关微粒浓度比值的对数关系如图所示。下列说法不正确的是( )
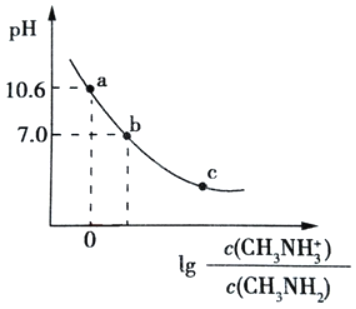
A.已知甲胺的碱性稍强于氨,甲胺在水中的电离方程式为CH3NH3++H2OCH3NH2+OH﹣
B.b点加入的盐酸体积V<20.00 mL
C.将等物质的量的CH3NH2和CH3NH3Cl 溶于蒸馏水,可得到 a 点对应的溶液
D.常温下,甲胺的电离常数为 Kb,则 pKb=-lgKb=3.4
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物![]() 如
如![]() 、
、![]() 、
、![]() 等
等![]() 应用很广,在一定条件下可以相互转化.
应用很广,在一定条件下可以相互转化.
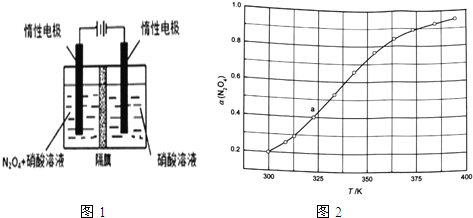
(1)从![]() 可通过电解或臭氧氧化
可通过电解或臭氧氧化![]() 的方法制备.电解装置如图1所示
的方法制备.电解装置如图1所示![]() 隔膜用于阻止水分子通过
隔膜用于阻止水分子通过![]() ,其阳极反应式为______.
,其阳极反应式为______.
已知:![]()
![]()
![]()
则反应![]() 的
的![]() ______.
______.
(2)从![]() 在一定条件下发生分解:
在一定条件下发生分解:![]() 某温度下测得恒容密闭容器中
某温度下测得恒容密闭容器中![]() 浓度随时间的变化如下表:
浓度随时间的变化如下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
设反应开始时体系压强为![]() ,第
,第![]() 时体系压强为p,则p:
时体系压强为p,则p:![]() ______;
______;![]() 内,
内,![]() 的平均反应速率为______.
的平均反应速率为______.
(3)从![]() 与
与![]() 之间存在反应
之间存在反应![]() 将一定量的
将一定量的![]() 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率![]() 随温度变化如图1所示.
随温度变化如图1所示.
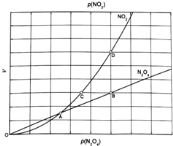
![]() 图中a点对应温度下,已知
图中a点对应温度下,已知![]() 的起始压强
的起始压强![]() 为108kPa,列式计算该温度下反应的平衡常数
为108kPa,列式计算该温度下反应的平衡常数![]() ______
______![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() .
.
![]() 由图推测
由图推测![]() 是吸热反应还是放热反应,说明理由______,若要提高
是吸热反应还是放热反应,说明理由______,若要提高![]() 转化率,除改变反应温度外,其他措施有______
转化率,除改变反应温度外,其他措施有______![]() 要求写出两条
要求写出两条![]() .
.
![]() 对于反应
对于反应![]() ,在一定条件下
,在一定条件下![]() 与
与![]() 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系:![]() ,
,![]() 其中,
其中,![]() 、
、![]() 是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,
是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,![]() 、
、![]() 与平衡常数
与平衡常数![]() 的关系是
的关系是![]() ______,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______.
______,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______.
查看答案和解析>>
科目: 来源: 题型:
【题目】从宏观和微观两个角度认识氯、硫、铁、铝等元素的单质及其化合物是学好中学化学的重要基础。完成下列填空:
(1)Cl在元素周期表中的位置为______________,由此可知,其最高价氧化物对应的水化物的化学式 为:______________ ,次氯酸分子的结构式为:_____________。
(2)Cl、S、Na三种元素形成简单离子其半径由大到小的顺序是_______________________(用离子符号 表示)。铝最高价氧化物对应的水化物表现出了独特的性质,其在水溶液中的电离方程式 为____________________________________________________________________________。
(3)硫和氯的非金属性强弱关系是_________________,试从原子结构的角度解释其原因。______________
(4)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。要证明Na2SO3具有还原 性,应选用的试剂有______________,看到的现象是 ____________________。要证明Na2SO3具有氧化性,应选用的试剂有___________________,反应的离子方程式是 ________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是![]()
A.能够使品红试液褪色的气体一定是![]()
B.常温下,铁、铝不与浓硫酸反应,因此可以用铁、铝容器贮存运输浓硫酸
C.硝酸铵受热易分解爆炸,实验室常加热氯化铵与氢氧化钙的混合物制备氨气
D.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.1mol CH3COONa与少量CH3COOH溶于水所得的中性溶液中,CH3COO﹣数目为NA
B.标准状况下,2.24 L甲醇中C﹣H键的数目为0.3NA
C.4.6gNa与100mL1.0mol/L的盐酸溶液反应,转移电子数目为0.2NA
D.NA个D2 16O分子中含有10NA个中子
查看答案和解析>>
科目: 来源: 题型:
【题目】关于氮的变化关系图如下:
![]()
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.上述反应中只有③属于氮的固定
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
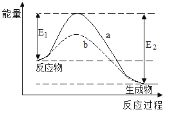
A.该反应为吸热反应
B.a与b相比,a的反应速率更快
C.a与b相比,反应的平衡常数一定不同
D.E2大于E1,说明总能量生成物比反应物低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com