
科目: 来源: 题型:
【题目】已知Cr2+不稳定,极易被氧气氧化,不与锌反应。醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、CrCl3溶液、CH3COONa溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如下图所示。制备过程中发生的相关反应如下所示:
Zn+2HCl===ZnCl2+H2↑
Zn+2CrCl3===2CrCl2+ZnCl2
2Cr2++4CH3COO-+2H2O===[Cr(CH3COO)2]2·2H2O(晶体)
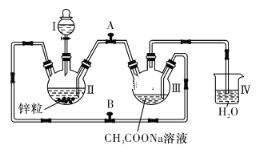
试回答下列问题:
(1)本实验中配制溶液所用的蒸馏水需事先煮沸,原因是__________。
(2)往仪器Ⅱ中加盐酸和CrCl3溶液的顺序最好是__________________________,理由是____________。
(3)为使生成的CrCl2溶液与CH3COONa溶液混合,应关闭阀门____(填“A”或“B”,下同),打开阀门_____。
(4)本实验中锌粒要过量,其原因除了使锌与CrCl3充分反应得到CrCl2外,另一个作用是________。仪器Ⅳ的主要作用是___________。
(5)已知实验时取用的CrCl3溶液中含溶质9.51 g,取用的CH3COONa溶液为1.5 L 0.1 mol/L,其他反应物足量。实验后得干燥的[Cr(CH3COO)2]2·2H2O 9.4 g,则该实验所得产品的产率为________(用百分数表示,保留3位有效数字)(不考虑溶解的醋酸亚铬水合物)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

下列说法错误的是:( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X + 3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(相对分子质量为376)是一种氧气吸收剂,为红棕色晶体,潮湿时易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
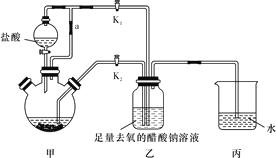
①待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
②将装置乙中混合物快速过滤、洗涤和干燥,称量得到 [Cr(CH3COO)2]2·2H2O。
③检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
④关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
(1)正确的实验步骤为:_________________。
(2)装置甲中连通管a的作用是_______________________________________。
(3)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为_______________________________________________。
(4)实现步骤①中溶液自动转移至装置乙中的实验操作为_______________________。
(5)步骤④目的是___________________________________________。
(6)洗涤产品时,依次用去氧的冷蒸馏水、无水乙醇、乙醚,目的是_________________。
(7)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.48g,则该实验所得产品的产率为____(不考虑溶解的醋酸亚铬水合物)(用百分数表示,保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】经研究光化学烟雾和酸雨的形成都与氮氧化物有关。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) K1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) K2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=______________(用K1、K2表示)
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g),△H,测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2(g),△H,测得NO的平衡转化率与温度及压强的关系如图所示:
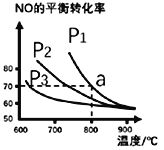
②对于气相反应,用某组分(B)的平衡分压强p(B)代替物质的量浓度c(B)也可表示平衡常数kp,求a点的平衡常数kp=_________(MPa)1(列出计算式,分压=总压×物质的量分数)。
③为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制了两条速率-浓度关系曲线:υ正~c(NO)和υ逆~c(CO2)

则:与曲线υ正~c(NO)相对应的是图中曲线___________ (填“甲”或“乙”)。当降低反应体系的温度,反应一段时间后,重新达到平衡,CO2和NO相应的平衡点分别为______(填字母)。
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-的废水,如图所示。电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
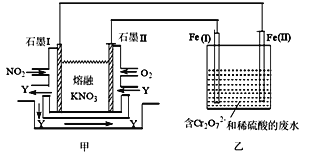
①甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为___________。乙池中的pH________(填“变大”“变小”或“不变”)。
②工作时,在相同条件下,甲池内消耗的O2和NO2的体积比为________。
(4)已知H3PO4为三元酸,Ka1=7.0×10-3 mol·L-1,Ka2=6.2×10-8mol·L-1,Ka3=4.5×10-13mol·L-1。则Na2HPO4水溶液呈________ (填“酸”、“中”、“碱”)性,用Ka与Kh的相对大小,说明判断理由_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
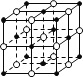
A.含16g氧原子的二氧化硅晶体中含有的σ键数目为 NA
B.58.5 g NaCl晶体中含有0.25NA个上图所示的结构单元
C.常温常压下,5gD2O含有的质子数、电子数、中子数均为2.5NA
D.标准状况下,22.4L乙烷中含有极性键的数目为6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D四种无机物具有如图所示的转化关系(反应条件及反应中的水均略去),且A、B、C含有同一种元素。下列说法错误的是
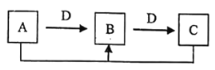
A.若A的溶液显碱性,则D可能是单质
B.A与C的反应可能是非氧化还原反应
C.A或D可能是目前使用最广泛的金属单质
D.若C是能使澄清石灰水变浑浊的气体,则A一定是单质
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应A2(g) + 2B2(g)![]() 2AB2(g) ΔH < 0,列说法正确的是 ( )
2AB2(g) ΔH < 0,列说法正确的是 ( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.升高温度有利于反应速率增加,从而缩短达到平衡的时间
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.O2、O3是氧元素的同素异形体,两者都为非极性分子
B.35Cl与37Cl互为同位素
C.乙二醇( ![]() ) 和甘油(
) 和甘油(![]() )互为同系物
)互为同系物
D.CH3CHO 与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,1 mol·L-1的HClO2和1 mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是( )

A.在0≤pH≤5时,HMnO4溶液满足pH=lg![]() +1
+1
B.当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
C.稀释前分别用1 mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
D.当稀释至pH均为3时,HMnO4溶液中的V等于1000 V0
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究学习小组要制备一种在水中溶解度很小的黄色化合物![]() ,并用滴定法测定其组成。已知
,并用滴定法测定其组成。已知![]() 在温度高于
在温度高于![]() 时易发生分解。实验操作如下:
时易发生分解。实验操作如下:
步骤一:将图甲分液漏斗中的草酸溶液滴入锥形瓶内,可生成黄色沉淀;
步骤二:称取黄色产物![]() 于锥形瓶中,加入足量的硫酸并水浴加热至
于锥形瓶中,加入足量的硫酸并水浴加热至![]() 。待固体全部溶解后,用胶头滴管吸出一滴溶液点在点滴板上,用铁氰化钾溶液检验,无蓝色沉淀产生;
。待固体全部溶解后,用胶头滴管吸出一滴溶液点在点滴板上,用铁氰化钾溶液检验,无蓝色沉淀产生;
步骤三:用![]() 标准液滴定步骤二所得的溶液;
标准液滴定步骤二所得的溶液;
步骤四:向步骤三滴定后的溶液中加足量的Zn粉和硫酸溶液,几分钟后用胶头滴管吸出一滴点在点滴板上,用KSCN溶液检验,若不显红色,过滤除去Zn粉,并用稀硫酸洗涤Zn粉,将洗涤液与滤液合并,用![]() 标准液滴定,用去高锰酸钾标准液
标准液滴定,用去高锰酸钾标准液![]() 。
。

(1)步骤一中将沉淀从反应混合物中分离出来的操作名称是________。
(2)步骤二中水浴加热并控制温度![]() 的理由是________,加铁氰化钾溶液无蓝色沉淀产生,此操作的目的是________。
的理由是________,加铁氰化钾溶液无蓝色沉淀产生,此操作的目的是________。
(3)步骤三盛装![]() 标准液的滴定管在滴定前后的液面如图乙所示,则消耗
标准液的滴定管在滴定前后的液面如图乙所示,则消耗![]() 标准液的体积为________,该滴定管为________滴定管
标准液的体积为________,该滴定管为________滴定管![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 。
。
(4)步骤四中滴定时发生反的离子方程式为________。若不合并洗涤液,则消耗![]() 标准液的体积将________
标准液的体积将________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。由以上数据计算黄色化合物的化学式为________。
。由以上数据计算黄色化合物的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com