
科目: 来源: 题型:
【题目】(1)松油醇(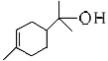 )的官能团的名称为_____________________。
)的官能团的名称为_____________________。
(2)苯与浓硫酸和浓硝酸的混合液共热的化学方程式为__________________________。
(3)1,3—丁二烯制备 1,4-二溴-2-丁烯的化学方程式为__________________________。
(4)燃烧法是测定有机化合物化学式的一种重要方法。在一定温度下取 0.1mol 某液态烃 A 在 O2 中完全燃烧,生成 CO2 和水蒸汽,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重16.2g,碱石灰增重 35.2g。则烃 A 的分子式___________,含三个甲基的烃 A 同分异构体的数目为_________,烃 A 的一种同分异构体,其核磁共振氢谱只有一个吸收峰,写出该同分异构体的结构简式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物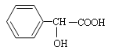 有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发 生显色反应的同分异构体有多少种(不考虑立体异构)
有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发 生显色反应的同分异构体有多少种(不考虑立体异构)
A.6 种B.9 种C.15 种D.19 种
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期非金属元素B、C、N、O、P、S、Cl,可形成各种单质、化合物的分子。
(1)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图。已知断裂1molN—N吸收167kJ热量,生成1molN![]() N放出942kJ热量,根据以上信息和数据,判断下列说法不正确的是___。
N放出942kJ热量,根据以上信息和数据,判断下列说法不正确的是___。
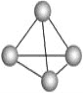
A.N4属于一种新型的化合物
B.N4分子中N—N键角为60°
C.N4分子中存在非极性键
D.1molN4转变成N2将吸收882kJ热量
(2)1919年,Langmuir提出等电子体的概念,由短周期元素组成的粒子,只要其原子数相同,各原子的最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似、物理性质相似。与CO互为等电子体的分子和离子分别为___和___(写1种,填化学式)。
(3)BF3和过量NaF作用可生成NaBF4,BF![]() 的空间立体构型为___。
的空间立体构型为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛、铁、砷、硒、锌等元素的单质及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为_______,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有________种。
(2)铁的第三电离能![]() 、第四电离能
、第四电离能![]() 分别为
分别为![]() 和
和![]() ,
,![]() 远大于
远大于![]() 的原因是______________________。
的原因是______________________。
(3)![]() 离子可用于
离子可用于![]() 的检验,其对应的酸有两种,分别为硫氰酸
的检验,其对应的酸有两种,分别为硫氰酸![]() 和异硫氰酸
和异硫氰酸![]() 。
。
①写出与![]() 互为等电子体的一种微粒_________
互为等电子体的一种微粒_________![]() 分子或离子
分子或离子![]() ;
;
②异硫氰酸的沸点比硫氰酸沸点高的原因是_______________。
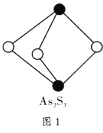
(4)成语“信口雌黄”中的雌黄分子式为![]() ,分子结构如图1所示,As原子的杂化方式为_______________。
,分子结构如图1所示,As原子的杂化方式为_______________。
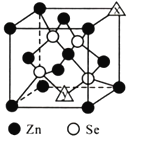
(5)离子化合物![]() 的晶胞结构如图2所示。一个晶胞含有的
的晶胞结构如图2所示。一个晶胞含有的![]() 键有__________个。
键有__________个。
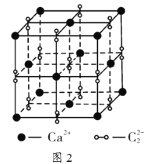
(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为____________![]() 填元素符号
填元素符号![]() ;该晶胞中硒原子所处空隙类型为____________
;该晶胞中硒原子所处空隙类型为____________![]() 填“立方体”、“正四面体”或“正八面体”
填“立方体”、“正四面体”或“正八面体”![]() ,该种空隙的填充率为____________;若该晶胞密度为
,该种空隙的填充率为____________;若该晶胞密度为![]() ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为![]() 。用
。用![]() 代表阿伏加德罗常数的数值,则晶胞参数a为____________nm。
代表阿伏加德罗常数的数值,则晶胞参数a为____________nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】大气中的含氮化合物主要来源于汽车尾气与工业废气排放。
(1)催化转化器可使汽车尾气中的主要污染物![]() 、
、![]() 进行相互反应,生成无毒物质,减少汽车尾气污染。
进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:![]()
![]()
![]()
![]()
![]()
![]()
计算尾气转化反应![]() 的
的![]() ________。
________。
(2)![]() 催化还原氮氧化物
催化还原氮氧化物![]() 技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为:
技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为:![]()
![]() 。反应在
。反应在![]() 密闭容器中进行,其它条件相同时,使用不同的催化剂A、B、C,产生
密闭容器中进行,其它条件相同时,使用不同的催化剂A、B、C,产生![]() 的物质的量随时间变化如图1所示。
的物质的量随时间变化如图1所示。
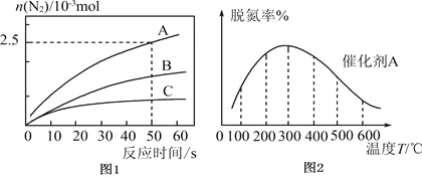
①下列有关说法正确的是___________。
![]() 反应在任何温度下均可自发进行
反应在任何温度下均可自发进行
![]() 在催化剂A作用下,经历
在催化剂A作用下,经历![]() ,平均反应速率
,平均反应速率![]()
![]() 使用催化剂C,达到平衡时,
使用催化剂C,达到平衡时,![]() 产率最小
产率最小
![]() 分离出反应体系中的
分离出反应体系中的![]() 有利于氮氧化物的脱除
有利于氮氧化物的脱除
②实验室在![]() 密闭容器中加入
密闭容器中加入![]() 、
、![]() ,达到平衡时氮氧化物脱氮率为
,达到平衡时氮氧化物脱氮率为![]() ,则平衡常数
,则平衡常数![]() ____________
____________![]() ;
;![]() 只列出计算式,不必求出计算结果
只列出计算式,不必求出计算结果![]()
③在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,![]() 之前,温度升高脱氮率逐渐增大,
之前,温度升高脱氮率逐渐增大,![]() 之后温度升高脱氮率逐渐减小
之后温度升高脱氮率逐渐减小![]() 假设催化剂活性不受影响
假设催化剂活性不受影响![]() ,写出脱氮率随温度变化的原因_________________。
,写出脱氮率随温度变化的原因_________________。
(3)以连二硫酸根![]() 为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
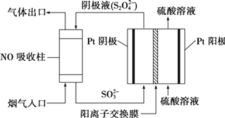
①阴极区的电极反应式为_________________;
②通电,当电路中转移![]() 电子时,可吸收的NO在标准状况下的体积为
电子时,可吸收的NO在标准状况下的体积为![]() 。则NO转化后的产物的化合价为_________________。
。则NO转化后的产物的化合价为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式正确的是
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目: 来源: 题型:
【题目】五氧化二钒![]() 在冶金、化工等领域有重要应用。实验室以含钒废料
在冶金、化工等领域有重要应用。实验室以含钒废料![]() 含
含![]() 、CuO、MnO、
、CuO、MnO、![]() 、
、![]() 、有机物
、有机物![]() 为原料制备
为原料制备![]() 的一种流程如下:
的一种流程如下:

已知:![]() 时,难溶电解质的溶度积常数如表所示:
时,难溶电解质的溶度积常数如表所示:
难溶电解质 |
|
|
|
|
|
|
|
(1)“焙烧”的目的是____________________________________________;
(2)“滤渣1”的用途为____________![]() 写出一种即可
写出一种即可![]() ;常温下,若“调pH”为7,
;常温下,若“调pH”为7,![]() 是否能沉淀完全:______
是否能沉淀完全:______![]() 填“是”或“否”
填“是”或“否”![]() ;
;![]() 溶液中离子浓度小于
溶液中离子浓度小于![]() 时,认为该离子沉淀完全
时,认为该离子沉淀完全![]()
(3)“沉锰”需将温度控制在![]() 左右,温度不能过高或过低的原因为_______________;
左右,温度不能过高或过低的原因为_______________;
(4)结晶所得的![]() 需进行水洗、干燥。证明
需进行水洗、干燥。证明![]() 已洗涤干净的实验操作及现象为_______________________;
已洗涤干净的实验操作及现象为_______________________;
(5)在煅烧![]() 生成
生成![]() 的过程中,固体残留率
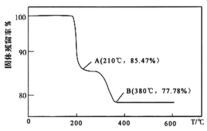
的过程中,固体残留率![]() 随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是_________、____________。
随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是_________、____________。![]() 填写分子式
填写分子式![]()
(6)为测定该产品的纯度,兴趣小组同学准确称取![]() 产品
产品![]() ,加入足量稀硫酸使其完全反应,生成
,加入足量稀硫酸使其完全反应,生成![]() ,并配成
,并配成![]() 溶液。取
溶液。取![]() 溶液用
溶液用![]() 的
的![]() 标准溶液滴定,滴定到终点时消耗标准液
标准溶液滴定,滴定到终点时消耗标准液![]() 。已知滴定过程中
。已知滴定过程中![]() 被氧化为
被氧化为![]() ,
,![]() 黄色
黄色![]() 被还原为
被还原为![]() 蓝色
蓝色![]() ,该反应的离子方程式为_____________;该产品的纯度为_________________。
,该反应的离子方程式为_____________;该产品的纯度为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[实验化学]
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
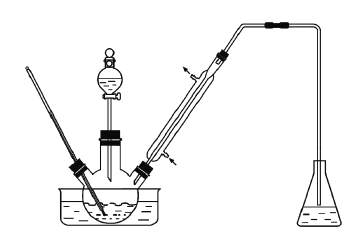
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是________,锥形瓶中的溶液应为________。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为_________。
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_________。
(5)步骤4中采用减压蒸馏技术,是为了防止_____。
附表 相关物质的沸点(101kPa)
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目: 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】对叔丁基苯酚![]() 可用于生产油溶性酚醛树脂等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
可用于生产油溶性酚醛树脂等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
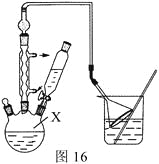
步骤1:按图16组装仪器,在X中加入2.2 mL叔丁基氯(过量)和1.41 g苯酚,搅拌使苯酚完全溶解。
步骤2:向X中加入无水AlCl3固体作催化剂,不断搅拌,有气体放出。
步骤3:反应缓和后,向X中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器X的名称为________。
(2)步骤2中发生主要反应的化学方程式为________。若该反应过于激烈,可采取的一种措施为________。
(3)图16中倒扣漏斗的作用是________。
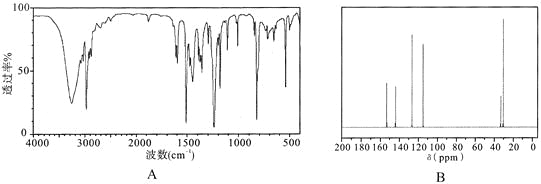
(4)实验结束后,对产品进行光谱鉴定结果如下。其中属于红外光谱的谱图是________(填字母)。
(5)本实验中,对叔丁基苯酚的产率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com