
科目: 来源: 题型:
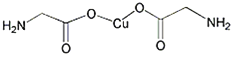
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如![]() 溶液常用作电解液、电镀液等.请回答以下问题:
溶液常用作电解液、电镀液等.请回答以下问题:
![]() 亚铜离子
亚铜离子![]() 基态时的核外电子排布式为 ______
基态时的核外电子排布式为 ______
![]() 晶体的堆积方式是 ______ ,其配位数为 ______ ;
晶体的堆积方式是 ______ ,其配位数为 ______ ;
![]() 往硫酸铜溶液中加入过量氨水,可生成
往硫酸铜溶液中加入过量氨水,可生成![]() ,下列说法正确的是 ______
,下列说法正确的是 ______
A.![]() 中所含的化学键有离子键、极性键和配位键
中所含的化学键有离子键、极性键和配位键
B.在![]() 中
中![]() 给出孤电子对,
给出孤电子对,![]() 提供空轨道
提供空轨道
C.![]() 组成元素中第一电离能最大的是氧元素
组成元素中第一电离能最大的是氧元素
D.![]() 与
与![]() 互为等电子体,空间构型均为正四面体
互为等电子体,空间构型均为正四面体
![]() 氨基乙酸铜的分子结构如图,碳原子的杂化方式为______。该分子中
氨基乙酸铜的分子结构如图,碳原子的杂化方式为______。该分子中![]() 键与
键与![]() 键个数比值为 ______
键个数比值为 ______
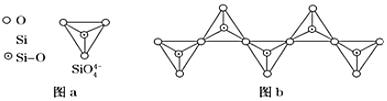
![]() 在硅酸盐中,
在硅酸盐中,![]() 四面体
四面体![]() 如图
如图![]() 通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根,Si与O的原子数之比为 ______ ,化学式为 ______ 。
通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根,Si与O的原子数之比为 ______ ,化学式为 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】根皮素J(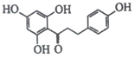 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
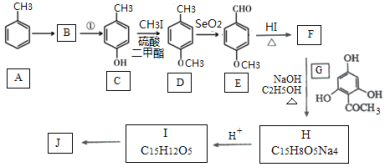
已知:
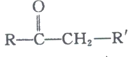 +R’’CHO
+R’’CHO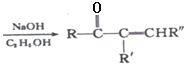 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
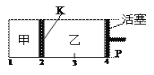
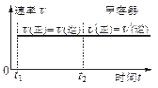
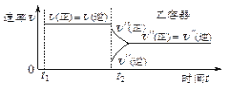
图1 图2 图3
A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温、恒容:N2 (g) + 3H2(g)![]() 2NH3(g);△H=-QkJ·mol-1。向甲、乙两个容积相同的密闭容器中分别充入1molN2、3molH2和2molNH3、1molAr,平衡时有关数据如下:
2NH3(g);△H=-QkJ·mol-1。向甲、乙两个容积相同的密闭容器中分别充入1molN2、3molH2和2molNH3、1molAr,平衡时有关数据如下:
容 器 | 甲 | 乙 |
平衡时NH3的体积分数 | ω1 | ω2 |
平衡时N2的浓度(mol·L-1) | c1 | c2 |
反应的能量变化(kJ) | Q1 | Q2 |
反应物的转化率 | α1 | α2 |
下列说法不正确的是
A.ω1=ω2B.c1 =c2C.Q1+Q2 =QD.α1+α2 = 1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①则反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
②根据表中数据,可推知该反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
(2)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
(3)在容积为VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡时CO的转化率与温度、压强的关系如图所示。
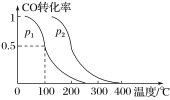
①p1__(填“大于”“小于”或“等于”)p2。
②在其他条件不变的情况下,再增加amolCO与2amolH2,达到新平衡时,CO的转化率__(填“增大”“减小”或“不变”,下同),平衡常数__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,体积均为2L的恒容密闭容器Ⅰ和Ⅱ,向Ⅰ中加入1molCO和2mol![]() ,向Ⅱ中加入2molCO和4mol
,向Ⅱ中加入2molCO和4mol![]() ,均发生下列反应并建立平衡:
,均发生下列反应并建立平衡:![]()
![]() 。测得不同温度下CO平衡转化率如图所示,下列说法正确的是
。测得不同温度下CO平衡转化率如图所示,下列说法正确的是![]()
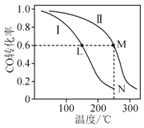
A.根据题干中信息,可推断该反应的![]()
B.反应中L、M两点容器内压强:![]()
C.可以计算出该反应处于N点时,化学平衡常数约为![]()
D.向N点平衡体系中再加入1mol![]() ,新平衡时氢气的增加量小于
,新平衡时氢气的增加量小于![]() mol
mol
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为__(用化学式表示);
(2)体积为10 mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1 000 mL,稀释后溶液的pH,前者__后者(填“>”、“<”或“=”);
(3)25℃时,pH之和为14的CH3COOH溶液与NaOH溶液混合,充分反应后溶液显中性,则所耗溶液的体积前者__后者(填“>”、“<”或“=”);
(4)若用NaOH标准溶液滴定未知浓度的醋酸,选择的指示剂应为_;
(5)下列离子CH3COO-、CO32-、HCO3-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为___;
(6)25℃时,把100mLpH为2的盐酸变为3,若分别用加入蒸馏水和加入pH为4的稀硫酸,则所需蒸馏水和pH为4的稀硫酸的体积之比为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学一选修5:有机化学基础]
聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT的一种合成路线如图所示:
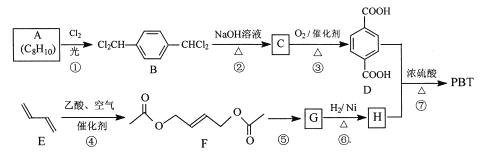
回答下列问题:
(1)A的结构简式是_________,C的化学名称是_________。
(2)⑤的反应试剂和反应条件分别是__________。
(3)F的分子式是_________,⑥的反应类型是_________。
(4)⑦的化学方程式是_________。
(5)M是H的同分异构体,同时符合_列条件的M可能的结构有_________种。
a.0.1 molM与足量金属钠反应生成氢气2.24 L(标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱显不3组峰,且峰而积之比为3:1:1的结构简式是_________。
(6)以2一甲基-1-3一丁二烯为原料(其它试剂任选),设计制备![]() 的合成路线:_________
的合成路线:_________
查看答案和解析>>
科目: 来源: 题型:
【题目】将Al条插入6 mol·L-1盐酸中,反应过程中产生H2速率变化情况如图1所示。下列说法错误的是
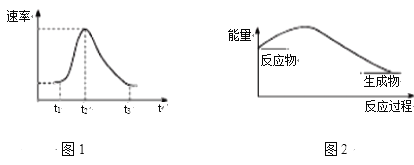
A. 图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜
B. 图1中影响t1~t2段速率变化的主要原因是反应放热导致溶液温度升高
C. 图1中影响t2~t3速率变化的主要因素是c(Cl-)
D. 图2可以表示该反应过程的能量变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四种溶液中,室温下由水电离生成的H+浓度之比(①:②:③:④)是( )
①pH=0的盐酸 ②0.1molL﹣1的盐酸 ③0.01molL﹣1的NaOH溶液④pH=11的NaOH溶液.
A.1:10:100:1 000B.0:1:12:11
C.14:13:12:11D.14:13:2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com